题目内容
3. 某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( )
某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O),下列说法正确的是( )| A. | 该装置将化学能转化为光能和电能 | |
| B. | a电极的反应为:3CO2+18H+-18e-═C3H8O+5H2O | |
| C. | 每生成1 mol O2,有44 g CO2被还原 | |
| D. | 该装置工作时H+从b极区向a极区迁移 |
分析 A、该装置是电解池装置,是将电能转化为化学能;
B、a与电源负极相连,所以a是负极阴极,电极反应式为:3CO2+18H++18e-=C3H8O+5H2O;
C、电池总的方程式为:6CO2+8H2O$\frac{\underline{\;通电\;}}{\;}$2C3H8O+9O2,即生成9mol的氧气,阴极有6mol的二氧化碳被还原,由此分析解答;
D、与电源正极相连的是电解池的阳极,负极相连的是电解池的阴极,a与电源负极相连,所以a是阴极,而电解池中氢离子向阴极移动.
解答 解:A、该装置是电解池装置,是将电能转化为化学能,所以该装置将光能和电能转化为化学能,故A错误;
B、a与电源负极相连,所以a是阴极,发生还原反应,电极反应式为:3CO2+18H++18e-=C3H8O+5H2O,故B错误;
C、电池总的方程式为:6CO2+8H2O$\frac{\underline{\;通电\;}}{\;}$2C3H8O+9O2,即生成9mol的氧气,阴极有6mol的二氧化碳被还原,也就是1mol的氧气,阴极有$\frac{2}{3}$mol的二氧化碳被还原,所以被还原的二氧化碳为29.3g,故C错误;
D、a与电源负极相连,所以a是阴极,而电解池中氢离子向阴极移动,所以H+从阳极b极区向阴极a极区迁移,故D正确;
故选D.
点评 本题考查电化学的相关知识,学生要清楚电解池的反应原理,阴极发生还原反应,阳极发生氧化反应,以及离子的移动方向就可以迅速解题了,比较容易.

练习册系列答案
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案
相关题目
15.现有四种元素的基态原子的电子排布式如下:①[Ne]3s23p4;②1s22s22p63s23p3;③1s22s22p5.则下列有关比较中不正确的是( )
| A. | 最高正化合价:③>②>① | B. | 原子半径:②>①>③ | ||
| C. | 电负性:③>①>② | D. | 第一电离能:③>②>① |
13.下列有关化学实验原理、操作以及现象预测和结论的叙述正确的是
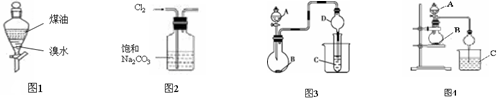 ( )
( )
 ( )
( )| A. | 利用图1完成“用煤油来萃取溴水中的Br2”,充分振荡后静置,上层变橙红色,下层几乎无色 | |
| B. | 实验室制取纯净Cl2,可用图2装置除去Cl2中的HCl气体杂质 | |
| C. | 图3中,若A、B、C分别为浓硫酸、Na2SO3固体、石蕊溶液,则C中溶液先变红后褪色 | |
| D. | 图4中,若A为浓氨水,B为生石灰,C硝酸银稀溶液,实验中可看到C中先变浑浊后变澄清,说明AgOH具有两性 |
 .其基态原子有7种能量不同的电子;
.其基态原子有7种能量不同的电子;
 在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.
在生产生活中,卤族元素(F、Cl、Br、I)的单质及化合物用途广泛.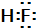 ;从HF、HCl混合气体中分离出HF的方法是冷凝.
;从HF、HCl混合气体中分离出HF的方法是冷凝. .
.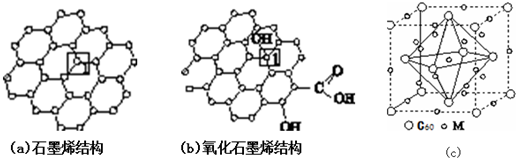
 )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图(d)所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,该晶体的晶胞结构如图(d)所示,立方烷分子填充在原C60晶体的分子间空隙中.则该复合型分子晶体的组成用二者的分子式可表示为C8H8.C60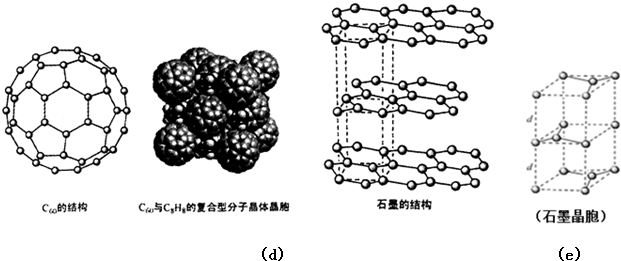
 X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是形成酸雨的主要气体之一;Z基态原子的M层与K层电子数相等;R2+的3d轨道有9个电子.请回答下列问题:
X、Y、Z、R为前四周期元素,且原子序数依次增大.XY2是形成酸雨的主要气体之一;Z基态原子的M层与K层电子数相等;R2+的3d轨道有9个电子.请回答下列问题: