��Ŀ����
2��ij��ҵ��ӦΪ��X2��g��+3Y2��g��?2XY3��g����ͼ���ʾ��һ���¶��´˷�Ӧ�����е������仯��ͼ���ʾ��2L���ܱ������з�ӦʱX2�����ʵ�����ʱ��ı仯���ߣ�ͼ���ʾ�������������������£��ı���ʼ��Y2�����ʵ����Դ˷�Ӧƽ���Ӱ�죮
����˵����ȷ���ǣ�������
| A�� | ��ͼ���֪�������ʵ��Ĵ�����E�͡�H����С | |
| B�� | ͼ����0��10 min�ڸ÷�Ӧ��ƽ������v��Y2��=0.045 mol•L-1•min-1����11 min�������������䣬ѹ�����������Ϊ1 L����n��X2���ı仯����Ϊd | |
| C�� | ͼ����a��b��c����������ƽ��״̬�У���Ӧ��X2��ת������ߵ���b�� | |
| D�� | ͼ����T1��T2��ʾ�¶ȣ���Ӧ�¶��µ�ƽ�ⳣ��ΪK1��K2����T1��T2��K1��K2 |
���� A���������ͷ�Ӧ����Ļ�ܣ����ʱ䲻�䣻
B�����v=$\frac{��c}{��t}$���㣬��11 min�������������䣬ѹ�����������Ϊ1 L��ѹǿ����ƽ�������ƶ���
C��n��Y2������Խ��X2��ת����Խ�ߣ�
D����ͼ��֪�÷�Ӧ�ġ�H��0��������������ͬʱ���¶�Խ�ͣ�ƽ�����ҽ��еij̶�Խ��ƽ��ʱXY3�İٷֺ���Խ��
��� �⣺A�������ܼ�СE�������ܸı��H��С����Hֻȡ���ڷ�Ӧ��������������״̬����A����
B��v��Y2��=3v��X2��=3��$\frac{\frac{0.6mol-0.3mol}{2L}}{10min}$=3��0.015 mol•L-1•min-1=0.045 mol•L-1•min-1����ѹ�����������ƽ�����ƣ�n��X2�����٣�n��X2���ı仯����Ϊd����B��ȷ��
C��n��Y2������Խ��X2��ת����Խ�ߣ�����c��X2ת������ߣ���C����
D����ͼ��֪�÷�Ӧ�ġ�H��0��������������ͬʱ���¶�Խ�ͣ�ƽ�����ҽ��еij̶�Խ��ƽ��ʱXY3�İٷֺ���Խ��ƽ�ⳣ��KԽ��T1��T2��K1��K2����D����
��ѡB��
���� ���⿼��ͼ��ѧƽ����ƶ���Ϊ��Ƶ���㣬����ͼ�������ƽ���ƶ�ԭ����Ӧ�á�K���¶ȵĹ�ϵΪ���Ĺؼ������ط�����Ӧ�������Ŀ��飬ע��ͼ����ƽ���ƶ��Ľ�ϣ���Ŀ�ѶȲ���

 ���Ž�������С״Ԫϵ�д�
���Ž�������С״Ԫϵ�д�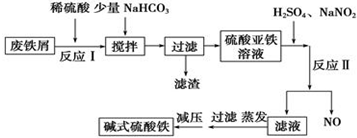
����������������������ʽ����ʱ��Һ��pH�����ʾ��
| ������ | Fe��OH��3 | Fe��OH��2 | Al��OH��3 |
| ��ʼ���� | 2.3 | 7.5 | 3.4 |
| ��ȫ���� | 3.2 | 9.7 | 4.4 |
��1����������NaHCO3��Ŀ���ǵ�����Һ��pH����ȥAl3+����pH�ķ�Χ4.4-7.5
��д�����ܷ��������ӷ���ʽ��Al3++3HCO3-=Al��OH��3��+3CO2��
��2����ʵ�������У���Ӧ���г�ͬʱͨ��O2���Լ���NaNO2��������O2��NaNO2�ڷ�Ӧ�о����������������뷴Ӧ��O2��11.2L����״���������൱�ڽ�ԼNaNO2�����ʵ���Ϊ2mol
��3����ʽ����������ˮ�������Fe��OH��2+�ɲ���ˮ������Fe2��OH��42+����ˮ�ⷴӦ�����ӷ���ʽΪ2Fe��OH��2++2H2O?Fe2��OH��42++2H+
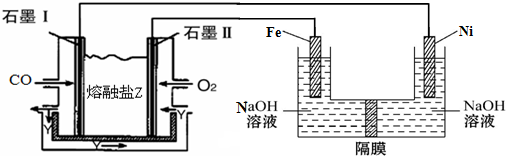
��4������CO��O2��������Na2CO3��ɵ�ȼ�ϵ�أ����õ�ⷨ�Ʊ���������Na2FeO4��װ����ͼ��ʾ������YΪCO2��
д��ʯīI�缫�Ϸ�����Ӧ�ĵ缫��ӦʽCO+CO32--2e-=2CO2
д������������FeO42-�ĵ缫��ӦʽΪFe-6e-+8OH-=FeO42-+4H2O��
CO��2CO��g��+O2��g���T2CO2��g����H=-566.0kJ/mol
���飺C3H8��g��+5O2��g���T3CO2��g��+4H2O��l����H=-2221.5kJ/mol
�����飺C4H10��g��+6.5O2��g���T4CO2��g��+5H2O��l����H=-2878.0kJ/mol
�춡�飺C4H10��g��+6.5O2��g���T4CO2��g��+5H2O��l����H=-2869.6kJ/mol
�����й�˵����ȷ���ǣ�������
| A�� | �����£��������ȼ����Ϊ-2878.0 kJ/mol | |
| B�� | ��ͬ�����ı���Ͷ���ֱ���ȫȼ�գ�ǰ����Ҫ�������࣬����������Ҳ�� | |
| C�� | �����£�CO��ȼ����Ϊ566.0 kJ/mol | |
| D�� | �������õ���Դ����ͨ����ѧ��Ӧ��õ� |
| A�� | ��ⷨ����ͭʱ���Դ�ͭ����������ͭ������ | |
| B�� | SiO2��s��+2C��s��=Si��s��+2CO��g���ڳ����²����Է����У���÷�Ӧ�ġ�H��0 | |
| C�� | �����£�NH4Cl��Һ��ˮϡ�ͣ�$\frac{{c��N{H_3}•{H_2}O��•c��{H^+}��}}{{c��N{H_4}^+��}}$���� | |
| D�� | C��s��+H2O��g��?CO��g��+H2��g������H��0����������������ʱ�������¶ȣ�����Ӧ���������淴Ӧ���ʼ�С��ƽ�������ƶ� |
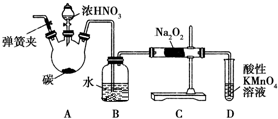 �������ƣ�NaNO2������Ϊ��ҵ�Σ���Ư�ס���Ƶȷ���Ӧ�ù㷺����ľ̿��Ũ���ᡢˮ��ͭΪԭ���Ʊ��������Ƶ�װ����ͼ��ʾ����֪�������£���2NO+Na2O2�T2NaNO2����3NaNO2+3HCl�T3NaCl+HNO3+2NO��+H2O�������������£�NO��NO2-������MnO4-��Ӧ����NO3-��Mn2+��
�������ƣ�NaNO2������Ϊ��ҵ�Σ���Ư�ס���Ƶȷ���Ӧ�ù㷺����ľ̿��Ũ���ᡢˮ��ͭΪԭ���Ʊ��������Ƶ�װ����ͼ��ʾ����֪�������£���2NO+Na2O2�T2NaNO2����3NaNO2+3HCl�T3NaCl+HNO3+2NO��+H2O�������������£�NO��NO2-������MnO4-��Ӧ����NO3-��Mn2+��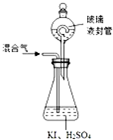 �������ȣ�ClO2������ɫ������ˮ�����壩�Ǹ�Ч���Ͷ������������ش��������⣺
�������ȣ�ClO2������ɫ������ˮ�����壩�Ǹ�Ч���Ͷ������������ش��������⣺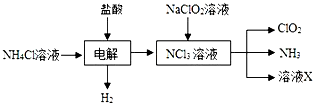
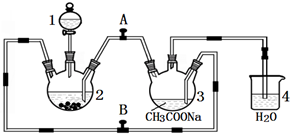 ���۸����ȶ������ױ����������������Ǹ�ˮ����{[Cr��CH3COO��2]2•2H2O����Է�������Ϊ376}��һ�����ɫ���壬��������ˮ���ѣ����������ᣬ�dz��õ��������ռ���ʵ��������п����CrCl3��Һ����������Һ������Ϊ��Ҫԭ���Ʊ������Ǹ�ˮ�����װ����ͼ��ʾ��
���۸����ȶ������ױ����������������Ǹ�ˮ����{[Cr��CH3COO��2]2•2H2O����Է�������Ϊ376}��һ�����ɫ���壬��������ˮ���ѣ����������ᣬ�dz��õ��������ռ���ʵ��������п����CrCl3��Һ����������Һ������Ϊ��Ҫԭ���Ʊ������Ǹ�ˮ�����װ����ͼ��ʾ��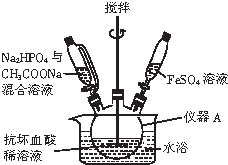 ������������[Fe3��PO4��2•8H2O]������ɫ��б���壬����ϡǿ�ᣬ������ˮ�����ᡢ������Ҫ��������������ﱵ�أ�ʵ�����Ʊ��������������װ�á���Ӧԭ����ʵ�鲽�����£�
������������[Fe3��PO4��2•8H2O]������ɫ��б���壬����ϡǿ�ᣬ������ˮ�����ᡢ������Ҫ��������������ﱵ�أ�ʵ�����Ʊ��������������װ�á���Ӧԭ����ʵ�鲽�����£�