题目内容
同温同压下,气体的密度之比等于相对分子质量之比,已知空气的平均相对分子质量为29,同温同压下,下列气体的密度比空气密度小的是( )
| A、二氧化氮 | B、二氧化碳 |
| C、二氧化硫 | D、一氧化碳 |
考点:物质的量的相关计算,阿伏加德罗定律及推论
专题:计算题
分析:同温同压下,气体的密度之比等于相对分子质量之比,空气的平均相对分子质量为29,同温同压下,气体的密度比空气密度小,则该气体的相对分子质量小于29.
解答:
解:同温同压下,气体的密度之比等于相对分子质量之比,空气的平均相对分子质量为29,同温同压下,气体的密度比空气密度小,则该气体的相对分子质量小于29,
A.二氧化碳的相对分子质量为46,大于29,不符合,故A错误;
B.二氧化碳的相对分子质量为44,大于29,不符合,故B错误;
C.二氧化硫的相对分子质量为64,大于29,不符合,故C错误;
D.CO的相对分子质量为28,小于29,符合题意,故D正确,
故选D.
A.二氧化碳的相对分子质量为46,大于29,不符合,故A错误;
B.二氧化碳的相对分子质量为44,大于29,不符合,故B错误;
C.二氧化硫的相对分子质量为64,大于29,不符合,故C错误;
D.CO的相对分子质量为28,小于29,符合题意,故D正确,
故选D.
点评:本题考查阿伏伽德罗定律及其推论,难度不大,注意根据PV=nRT理解阿伏伽德罗定律及其推论.

练习册系列答案
相关题目
下列实验过程中,始终无明显现象的是( )
| A、NO2通入FeSO4溶液中 |
| B、CO2通入CaCl2溶液中 |
| C、NH3通入AlCl3溶液中 |
| D、SO2通入Ba(NO3)2溶液中 |
已知在1×105Pa、298K条件下,2mol氢气燃烧生成水蒸气放出484kJ热量,下列热化学方程式正确的是( )
| A、H20(g)═H2 (g)+l/202(g)△H=+242kJ.mol-l | ||
| B、2H2 (g)+02 (g)═2H20(1)△H=-484kJ.mol-l | ||
C、H2(g)+
| ||
| D、2H2(g)+02( g)═2 H2 0(g)△H=-242kJ.mol-1 |
C-12原子的质量是1.992×10-23g,中子的质量是1.674×10-24 g,则中子的相对质量为( )
| A、1 | B、1.000 |
| C、1.007 | D、1.008 |
下列有关氧化还原反应的说法正确的是( )
| A、氧化还原反应的实质是元素的化合价发生了升降 |
| B、置换反应一定是氧化还原反应 |
| C、得到电子数越多的物质,其氧化性越强 |
| D、元素的化合态变游离态,该元素一定被氧化 |
取19.2g铜跟少量的浓硝酸反应,铜全部溶解后,收集到NO2、NO混合气体的体积11.2L(标准状况),反应消耗硝酸的物质的量是( )
| A、0.5mol |
| B、0.8mol |
| C、1.1mol |
| D、1.2mol |
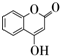 是一种医药中间体,常用来制备抗凝血药,可通过如图路线合成
是一种医药中间体,常用来制备抗凝血药,可通过如图路线合成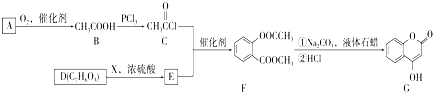
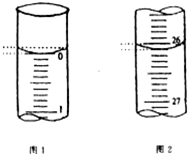 硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C被完全氧化,剩余的I2用Na2S2O3标准溶液滴定,可测定溶液中维生素C的含量.发生的反应为:C6H8O6+I2═C6H6O6+2H++2I-2S2O32-+I2═S4O62-+2I-
硫代硫酸钠(Na2S2O3)是常用的还原剂.在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C被完全氧化,剩余的I2用Na2S2O3标准溶液滴定,可测定溶液中维生素C的含量.发生的反应为:C6H8O6+I2═C6H6O6+2H++2I-2S2O32-+I2═S4O62-+2I-