题目内容
6.实验室中,用足量的锌粒与一定量的稀盐酸反应,为了减小反应速率,但不影响产生H2的总量,下列措施能达到目的是( )| A. | 向稀盐酸中加NaNO3溶液 | B. | 向稀盐酸中加碳酸钠固体 | ||
| C. | 将锌粒制成薄片 | D. | 向稀盐酸中加食盐水 |
分析 产生氢气的量不变,则保证盐酸完全和金属反应生成氢气;加快反应速率,应增大盐酸的浓度和升高温度.
解答 解:A.向稀盐酸中加入硝酸钠溶液,相当于含有硝酸,硝酸和Zn反应生成氮氧化物而不是氢气,导致生成氢气的总量减少,故A错误;
B.加入碳酸钠固体,碳酸钠和稀盐酸反应生成二氧化碳,导致生成氢气总量减少,故B错误;
C.将锌粒制成薄片,增大反应物接触面积,加快反应速率,故C错误;
D.向稀盐酸中加入食盐水,导致氢离子浓度减小但氢离子总物质的量不变,则化学反应速率降低,但生成氢气总量不变,故D正确;
故选D.
点评 本题考查了影响反应速率的因素,为高频考点,侧重考查学生分析判断能力,注意题干中限制性条件“反应速率改变但生成氢气总量不变”,题目难度不大.

练习册系列答案
 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案
相关题目
14.下列排列顺序正确的是( )
①热稳定性:H2O>HF>H2S;
②原子半径:K>Mg>S;
③酸性:H3PO4>H2SO4>HClO4;
④还原性:I->Br->Cl-.
①热稳定性:H2O>HF>H2S;
②原子半径:K>Mg>S;
③酸性:H3PO4>H2SO4>HClO4;
④还原性:I->Br->Cl-.
| A. | ①③ | B. | ②④ | C. | ②③ | D. | ①④ |
1.下列说法正确的是( )
| A. | 因SiO2不溶于水,故H2SiO3不是SiO2对应的酸,或者说SiO2不是H2SiO3的酸酐 | |
| B. | CO2通入水玻璃(Na2SiO3溶液)可以得到硅酸 | |
| C. | 因为高温时SiO2与Na2SiO3反应生成CO2,故硅酸的酸性比碳酸强 | |
| D. | 因为NH3•H2O是弱碱,所以不能用氨水与FeCl3溶液反应制取Fe(OH)3 |
18.下列能级符号表示错误的是( )
| A. | 2p | B. | 4d | C. | 5s | D. | 3f |
15.已知a、I、e为三种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
物质A由a、e 构成,B、C、D、K都是单质,反应①--⑤都是用于工业生产的反应,
各有关物质之间的相互反应转化关系如图所示:
请填写下列空白:
(1)写出下列B的化学式Cl2,F的电子式 .;
.;
(2)写出反应H+E(溶液)→M的离子方程式:H++ClO-═HClO;
(3)用单线桥表示I与K反应的电子转移方向和数目: .
.
| 粒子代码 | a | I | e |
| 原子核数 | 单核 | 四核 | 二核 |
| 粒子的电荷数 | 一个单位正电荷 | 0 | 一个单位负电荷 |
各有关物质之间的相互反应转化关系如图所示:

请填写下列空白:
(1)写出下列B的化学式Cl2,F的电子式
 .;
.;(2)写出反应H+E(溶液)→M的离子方程式:H++ClO-═HClO;
(3)用单线桥表示I与K反应的电子转移方向和数目:
 .
.
16.化合物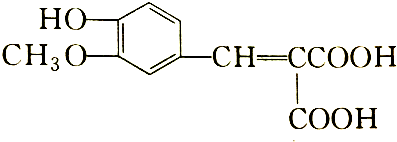 含有的官能团有( )
含有的官能团有( )
 含有的官能团有( )
含有的官能团有( )| A. | 5种 | B. | 4种 | C. | 3种 | D. | 2种 |
 ;
; ;A、B、E形成的化合物
;A、B、E形成的化合物 ;D、E形成的化合物
;D、E形成的化合物 .
.