题目内容
9.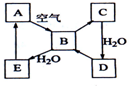 下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.(1)写出A在加热条件下与H2反应的化学方程式H2+S$\frac{\underline{\;\;△\;\;}}{\;}$H2S
(2)写出E与A的氢化物反应生成A的化学方程式H2SO3+2H2S═3S↓+3H2O
(3)写出一个由D生成B的化学方程式C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O或Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O等;
(4)将5mL0.10mol•L-1的E溶液与10mL0.10mol•L-1的NaOH溶液混合.
①写出反应的离子方程式H2SO3+2OH-═SO32-+2H2O;
②反应后溶液的pH大于7(填“大于”、“小于”或“等于”),理由是Na2SO3溶液中SO32-发生水解使溶液显碱性;
③加热反应后的溶液,其pH增大(填“增大”、“不变”或“减小”),理由是升高温度促进Na2SO3溶液的水解.
分析 固态单质A能与空气中的氧气反应生成气体物质B,则A可能为C或S等,假定为S,则B为SO2,C为SO3,它们的相对分子质量为64:80=4:5,恰好与题意相符(同时也证明A不是C),则D为H2SO4,它是一种重要的工业原料,与题意也相符,进一步证明A为S,E为H2SO3,结合物质的性质以及题目要求可解答该题.
解答 解:固态单质A能与空气中的氧气反应生成气体物质B,则A可能为C或S等,假定为S,则B为SO2,C为SO3,它们的相对分子质量为64:80=4:5,恰好与题意相符(同时也证明A不是C),则D为H2SO4,它是一种重要的工业原料,与题意也相符,进一步证明A为S,E为H2SO3,
(1)A为S,可与氢气反应生成硫化氢,反应的方程式为H2+S$\frac{\underline{\;\;△\;\;}}{\;}$H2S,故答案为:H2+S$\frac{\underline{\;\;△\;\;}}{\;}$H2S;
(2)H2SO3与H2S反应生成S,反应的方程式为H2SO3+2H2S═3S↓+3H2O,故答案为:H2SO3+2H2S═3S↓+3H2O;
(3)浓硫酸可与C、Cu等还原性物质在加热的条件下反应生成SO2,反应的方程式可为C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O或Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O等,
故答案为:C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+2SO2↑+2H2O或Cu+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O等;
(4)①将5mL 0.10mol•L-1的H2SO3溶液与10mL 0.10mol•L-1的NaOH溶液混合,二者恰好反应,反应的离子方程式为H2SO3+2OH-═SO32-+2H2O,
故答案为:H2SO3+2OH-═SO32-+2H2O;
②反应生成Na2SO3,为强碱弱酸盐,水解呈碱性,溶液pH>7,故答案为:大于;Na2SO3溶液中SO32-发生水解使溶液显碱性;
③水解反应为吸热过程,升高温度促进水解,故答案为:增大;升高温度促进Na2SO3溶液的水解.
点评 本题考查无机物的推断,为高频考点,侧重于学生的分析能力的考查,注意能与氧气反应生成气体的固体单质有C、S等元素,可以此作为该题的突破口进行推断,注意把握物质的化学性质,能熟练书写反应的化学方程式.

| A. | 含5个碳原子的有机物,每个分子中最多可形成4个C-C键 | |
| B. | 正戊烷分子中所有原子均在一条直线上 | |
| C. | 碳碳间以单键结合,碳原子剩余价键全部与氢原子结合的烃一定符合通式CnH2n+2 | |
| D. | 分子式为C3H8与C6H14的两种有机物一定互为同系物 |
| A. | 乙醇是食醋的主要成分 | |
| B. | C2H5OH中C、H、O元素的质量比是2:6:1 | |
| C. | 乙醇不能溶于水 | |
| D. | C2H5OH中C元素的质量分数是$\frac{12×2}{12×2+1×6+16×1}$ |
| A. | 23Na37Cl中质子数和中子数之比是7:8 | |
| B. | KIO3和NaHSO3都是强电解质 | |
| C. | KIO3作氧化剂发生氧化反应 | |
| D. | 生成1mo1KI时,转移6mo1电子 |
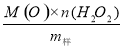 ×100来衡量其优劣,13%以
×100来衡量其优劣,13%以 上为优等品。一种制备过碳酸钠的工艺流程如图:
上为优等品。一种制备过碳酸钠的工艺流程如图: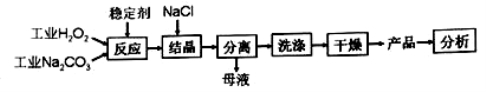
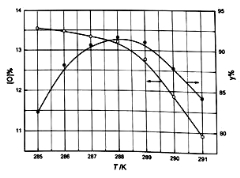
 ___.
___.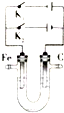 铁及其化合物是一类重要的物质,在人类的生产和生活中具有广泛的用途.
铁及其化合物是一类重要的物质,在人类的生产和生活中具有广泛的用途. CCH3CH2OHD
CCH3CH2OHD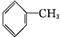 ECH3COOH
ECH3COOH
 CH3COOCH2CH3+H2O.
CH3COOCH2CH3+H2O.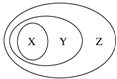 如表所列物质或概念间的从属关系符合如图所示关系的是( )
如表所列物质或概念间的从属关系符合如图所示关系的是( )