题目内容
过碳酸钠(2Na2CO3•3H2O2)是由Na2CO3与H2O2复合而形成的一种固体放氧剂,同时具有Na2CO3和H2O2双重性质。可用于洗涤、纺织、医药、卫生等领域.工业上常以过碳酸钠产品中活性氧含量([O]%=  ×100来衡量其优劣,13%以
×100来衡量其优劣,13%以 上为优等品。一种制备过碳酸钠的工艺流程如图:
上为优等品。一种制备过碳酸钠的工艺流程如图:

回答下列问 题:
题:
(1)过碳酸钠受热易分解,写出反应的化学方程式_____________________.
(2)稳定剂及反应温度等因素对产品质量有很大影响.
①下列试剂中,可能用作“稳定剂”的是__________(填字母).
a.MnO2 b.KI c .Na2SiO3 d.FeCl3
.Na2SiO3 d.FeCl3
②反应温度对产品产率(y%)及活性氧含量的影响如下图所示.要使产品达到优等品且产率超过90%合适的反应温度范围是_______________.

③“结晶”时加入NaCl的目的是____________ .
(3)“母液”中可循环利用的主要物质是_________________ ___.
___.
(4)产品中活性氧含量的测定方法:称量0.1600g样品,在250mL锥形瓶中用100mL 0.5mol•L-1硫酸溶解完全,立即用0.02000mol•L-1高锰酸钾标准溶液滴定,至溶液呈浅红色且半分钟内不褪色即为终点,平行三次,消耗KMnO4溶液的平均体积为26.56mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗KMn04溶液的平均体积为2.24mL.
①过碳酸钠与硫酸反应,产物除硫酸钠和水外,还有_______________.
②测定时,若用工业盐酸代替硫酸,分析对测定结果的影响 (填“偏大”、“偏小”或“不变”)及其原因____________.
③该样品的活性氧含量为__________% 。
 优等生题库系列答案
优等生题库系列答案| A. | 75 mL 2 mol/L的CaCl2 | B. | 100 mL 2 mol/L的NH4Cl | ||
| C. | 150 mL 1mol/L的KCl | D. | 100 mL 3 mol/L的NaCl |
含A元素的一种单质是一种重要的半导体材料,含A元素的一种化合物C可用于制造高性能的现代通讯材料—光导纤维,C与烧碱反应生成含A元素的化合物D
(1)B元素的原子最外层电子数与A相同,则B在元素周期中的位置___ __.
(2)写出易与C发生反应的酸与C反应的化学方程式是______________.
(3)将C与纯碱混合高温熔融时也发生化学反应生成D,同时还生成B的最高价氧化物E:将全部的E与全部的D在足量的水中混合后,又发生化学反应生成含A的化合物F.
①写出生成D的化学反应方程式:______________.
②要将纯碱高温熔化,下列坩埚中不可选用的是__________.
A.普通玻璃坩埚 | B.石英玻璃坩埚 | C.铁坩埚 | D.瓷坩埚. |
③将过量的E通入D的溶液中发生反应的离子方程式是:_________________。
(4)100 g C与石灰石的混合物充分反应后,生成的气体在标准状况下的体积为11.2 L,100 g混合物中石灰石的质量分数是____________。
 ,这种炔烃的名称为( )
,这种炔烃的名称为( )| A. | 5-甲基-3-乙基-1-己炔 | B. | 5-甲基-3-乙基-2-己炔 | ||
| C. | 4-甲基-5-乙基-2-己炔 | D. | 2-甲基-4-乙基-5-己炔 |



 念出发,下列实验不宜用图7所示装置进行的是
念出发,下列实验不宜用图7所示装置进行的是
 离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为( )
离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为( )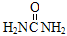
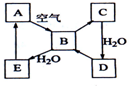 下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.