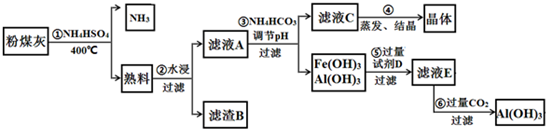
题目内容
1.2011年3月18日至19日,受“吃碘盐能防止核辐射”等谣言的影响,我国部分地区出现抢购食盐现象.已知碘盐的主要成分是KIO3和NaCl,KIO3与NaHSO3发生反应:2KIO3+6NaHSO3═2KI+3Na2SO4+3H2SO4,下列说法中不正确的是( )| A. | 23Na37Cl中质子数和中子数之比是7:8 | |
| B. | KIO3和NaHSO3都是强电解质 | |
| C. | KIO3作氧化剂发生氧化反应 | |
| D. | 生成1mo1KI时,转移6mo1电子 |
分析 A.原子中,质子数+中子数=质量数;
B.KIO3和NaHSO3在水溶液中或熔化状态下均能完全电离;
C.2KIO3+6NaHSO3=2KI+3Na2SO4+3H2SO4中,I元素的化合价降低;
D.2KIO3+6NaHSO3=2KI+3Na2SO4+3H2SO4中,I元素的化合价由+5降低到-1.
解答 解:A.原子中,质子数+中子数=质量数,23Na37Cl中质子数和中子数之比是(11+17):(12+20)=7:8,故A正确;
B.KIO3和NaHSO3在水溶液中或熔化状态下均能完全电离,则KIO3和NaHSO3都是强电解质,故B正确;
C.2KIO3+6NaHSO3=2KI+3Na2SO4+3H2SO4中,I元素的化合价降低,则KIO3作氧化剂发生还原反应,故C错误;
D.2KIO3+6NaHSO3=2KI+3Na2SO4+3H2SO4中,I元素的化合价由+5降低到-1,所以生成1mo1KI时,转移6mo1电子,故D正确;
故选C.
点评 本题以碘及其化合物的性质考查物质的分类、氧化还原反应及原子的构成,综合性较强,注重基础知识和高频考点的考查,题目难度不大.

练习册系列答案
 习题精选系列答案
习题精选系列答案
相关题目
6.电解法制取有广泛用途的Na2FeO4,同时获得氢气.工作原理如图1所示,c( Na2FeO4)随初始c(NaOH)的变化如图2.
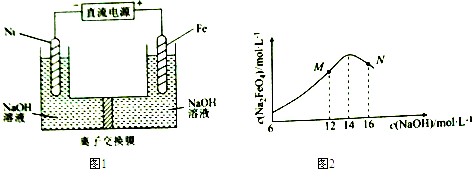
已知:FeO42-为紫红色;Na2FeO4只在强碱性条件下稳定,易被H2还原;溶液中OH-浓度过高,铁电极区会产生红褐色物质.下列说法错误的是( )

已知:FeO42-为紫红色;Na2FeO4只在强碱性条件下稳定,易被H2还原;溶液中OH-浓度过高,铁电极区会产生红褐色物质.下列说法错误的是( )
| A. | 制备Na2FeO4的电极反应为Fe-6e-+8OH-=FeO42-+4H2O | |
| B. | 电解过程中,须将阴极产生的气体及时排出 | |
| C. | MN两点中c(Na2FeO4)低于最高值的原因不同,在M点会有Fe(OH)3生成 | |
| D. | 图1中的离子交换膜为阴离子交换膜,电解过程中,阴极区附近pH会增大 |
13.下列物质属于糖类的是( )
| A. | 蛋白质 | B. | 花生油 | C. | 柠檬黄 | D. | 纤维素 |
10.在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质.下列实验现象和结论不一致的是( )
| A. | 加入有色布条,一会儿有色布条褪色,说明溶液中有HC1O存在 | |
| B. | 溶液呈黄绿色,且有刺激性气味,说明有C12分子存在 | |
| C. | 加入硝酸酸化的AgNO3溶液产生白色沉淀,说明有C1-存在 | |
| D. | 加入NaOH溶液,氯水黄绿色消失,说明有HC1O分子存在 |
11.组成和结构可用  表示的有机物共有(不考虑立体异构体)( )
表示的有机物共有(不考虑立体异构体)( )
 表示的有机物共有(不考虑立体异构体)( )
表示的有机物共有(不考虑立体异构体)( )| A. | 12种 | B. | 28种 | C. | 32种 | D. | 36种 |
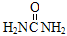
 2,3-二甲基戊烷
2,3-二甲基戊烷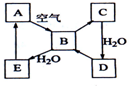 下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.
下图表示某固态单质A及其化合物之间的转化关系(某些产物和反应条件已略去).化合物B在常温常压下为气体,B和C的相对分子质量之比为4:5,化合物D是重要的工业原料.