题目内容
某含氧强酸HmXOn,相对分子质量为A,将它溶于水,测得溶液的氢离子浓度为2mol/L,溶液的质量分数为20%,密度为1.5g/cm3,则m值为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
考点:物质的量浓度的相关计算
专题:
分析:假设溶液体积为1L,根据n=cV计算n(H+),再根据m=ρV计算溶液质量,结合质量分数计算HmXOn的质量,根据n=
计算n(HmXOn),进而计算m的值.
| m |
| M |
解答:
解:假设溶液体积为1L,则:n(H+)=1L×2mol/L=2mol,
溶液质量=1000mL×1.5g/mL=1500g,HmXOn的质量=1500g×20%=300g,n(HmXOn)=
=
mol,
mol×m=2mol,故m=
,
故选B.
溶液质量=1000mL×1.5g/mL=1500g,HmXOn的质量=1500g×20%=300g,n(HmXOn)=
| 300g |
| Ag/mol |
| 300 |
| A |
| 300 |
| A |
| A |
| 150 |
故选B.
点评:本题考查物质的量浓度有关计算,难度不大,注意对公式的理解与灵活应用.

练习册系列答案
相关题目
氯酸(HClO3)是一种强氧化性酸.若将铜粉投入氯酸溶液中,下列物质一定不可能生成的是( )
| A、氯酸铜 | B、高氯酸铜 |
| C、氯化铜 | D、氢气 |
将一定量的由Na、Na2O、Na2O2组成的混合物与足量的水充分反应,收集到一定体积的混合气体,将混合气体通过放电后恰好完全反应,则原混合物中Na、Na2O、Na2O2物质的量之比为( )
| A、1:1:1 |
| B、1:2:1 |
| C、2:3:1 |
| D、2:2:1 |
硝酸汞和碘化钾溶液混合后会生成红色的碘化汞沉淀,为了探究硝酸汞和碘化钾溶液之间能否发生氧化还原反应,研究人员设计了如图的实验装置,结果电流计指针发生了偏转,下列分析正确的是( )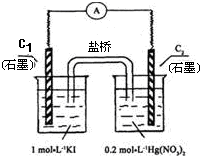

| A、C1电极上发生的反应是:2I--2e-=I2 |
| B、如图装置的电流方向是从C1到C2 |
| C、盐桥中的K+离子向C1电极移动 |
| D、装置发生的总反应是Hg2++2I-=HgI2↓ |
化学在生活中无处不在,其中不科学的是( )
| A、含食品添加剂的食品都不属于绿色食品 |
| B、维生素C具有还原性,在人体内起抗氧化作用 |
| C、为防止月饼等富脂食品氧化变质,常在包装袋中放入硫酸亚铁 |
| D、地震后防疫人员在震区周围撒石灰,其作用是进行环境消毒,防止灾后出现疫情 |
等质量的铝分别与足量的稀盐酸和氢氧化钠溶液反应,当铝完全溶解时,反应中消耗的HCl和NaOH物质的量之比为( )
| A、1:1 | B、2:1 |
| C、1:2 | D、3:1 |
