题目内容
将一定量的由Na、Na2O、Na2O2组成的混合物与足量的水充分反应,收集到一定体积的混合气体,将混合气体通过放电后恰好完全反应,则原混合物中Na、Na2O、Na2O2物质的量之比为( )
| A、1:1:1 |
| B、1:2:1 |
| C、2:3:1 |
| D、2:2:1 |
考点:化学方程式的有关计算,有关混合物反应的计算
专题:计算题
分析:Na、Na2O、Na2O2 的混合物与足量的水反应得到的气体是氢气和氧气的混合物,将该混合气体通过放电,恰好完全反应,说明氢气和氧气反应的物质的量之比恰好等于它们反应的计量数之比,氢气来源于钠和水的反应,氧气来源于过氧化钠与水的反应,通过钠与水、过氧化钠与水、氢气和氧气反应的方程式,找出钠与过氧化钠的物质的量之比.
解答:
解:Na与水发生反应:2Na+2H2O=2NaOH+H2↑,过氧化钠与水发生反应:2Na2O2+2H2O=4NaOH+O2↑,
将混合气体通过放电,发生反应:2H2+O2
2H2O,氢气与氧气恰好完全反应,说明氢气和氧气反应的物质的量之比为2:1,2mol氢气需要4molNa,1mol氧气需要2mol过氧化钠,故所以钠与过氧化钠的物质的量之比为4mol:2mol=2:1,与氧化钠的物质的量无关,故选CD.
将混合气体通过放电,发生反应:2H2+O2
| ||
点评:本题考查混合物计算、化学方程式计算,难度中等,注意根据方程式进行解答.

练习册系列答案
相关题目
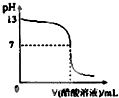 常温下,向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1醋酸溶液,所得滴定曲线如图所示.下列说法正确的是( )
常温下,向10mL 0.1mol?L-1NaOH溶液中逐滴加入0.1mol?L-1醋酸溶液,所得滴定曲线如图所示.下列说法正确的是( )| A、pH=7时,所加醋酸溶液的体积为10mL |
| B、pH<7时,溶液中c(CH3COO-)<c(Na+) |
| C、醋酸滴入10ml时,c(Na+)═c(CH3COOH)+c(CH3COO-) |
| D、继续滴加0.1 mol?L-1醋酸溶液,溶液pH可以变为1 |
下列说法符合事实的是( )
| A、漂白精的有效成分是NaClO |
| B、碘化钾的水溶液遇淀粉现蓝色 |
| C、硫在空气中燃烧生成SO2,在纯氧中生成SO3 |
| D、漂白精露置空气中变质,既发生氧化反应又发生非氧化还原反应 |
某含氧强酸HmXOn,相对分子质量为A,将它溶于水,测得溶液的氢离子浓度为2mol/L,溶液的质量分数为20%,密度为1.5g/cm3,则m值为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
卤代烃RCH2CH2X的化学键如图,则下列说法中正确的是( )
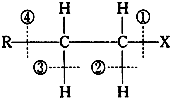

| A、当卤代烃发生水解反应时,被破坏的键是①和④ |
| B、当卤代烃发生水解反应时,被破坏的键是① |
| C、当卤代烃发生消去反应时,被破坏的键是①和③ |
| D、当卤代烃发生消去反应时,被破坏的键是①和② |

 如图甲所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光的地方,让混合气体缓慢地反应一段时间.试回答下列问题:
如图甲所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光的地方,让混合气体缓慢地反应一段时间.试回答下列问题: