题目内容
等质量的铝分别与足量的稀盐酸和氢氧化钠溶液反应,当铝完全溶解时,反应中消耗的HCl和NaOH物质的量之比为( )
| A、1:1 | B、2:1 |
| C、1:2 | D、3:1 |
考点:铝的化学性质
专题:几种重要的金属及其化合物
分析:铝与盐酸发生反应:2Al+6HCl=2AlCl3+3H2↑,铝与NaOH溶液发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,等质量的铝的物质的量相同,结合反应计算.
解答:
解:等质量的铝的物质的量相同,设Al均为2mol,
由2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,消耗的HCl和NaOH物质的量之比为6mol:2mol=3:1,
故选D.
由2Al+6HCl=2AlCl3+3H2↑、2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,消耗的HCl和NaOH物质的量之比为6mol:2mol=3:1,
故选D.
点评:本题考查化学方程式的有关计算,为高频考点,把握Al完全反应及发生的反应是解答的关键,注意利用赋值法解答,题目难度不大.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
某含氧强酸HmXOn,相对分子质量为A,将它溶于水,测得溶液的氢离子浓度为2mol/L,溶液的质量分数为20%,密度为1.5g/cm3,则m值为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
卤代烃RCH2CH2X的化学键如图,则下列说法中正确的是( )
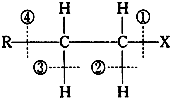

| A、当卤代烃发生水解反应时,被破坏的键是①和④ |
| B、当卤代烃发生水解反应时,被破坏的键是① |
| C、当卤代烃发生消去反应时,被破坏的键是①和③ |
| D、当卤代烃发生消去反应时,被破坏的键是①和② |
可用Zn+Br2═ZnBr2 设计成蓄电池,其中正极反应是( )
| A、Zn→Zn2++2e- |
| B、Br2+2e-→2Br- |
| C、2Br-→Br2+2e- |
| D、Zn2++2e-→Zn |
可以将反应Zn+Br2═ZnBr2设计成蓄电池,下列4个电极反应其中表示充电时的阳极反应和放电时的负极反应的分别是( )
①Br2+2e-=2Br-②2Br--2e-=Br2③Zn-2e-=Zn2+ ④Zn2++2e-=Zn.
①Br2+2e-=2Br-②2Br--2e-=Br2③Zn-2e-=Zn2+ ④Zn2++2e-=Zn.
| A、②和③ | B、②和① |
| C、③和① | D、④和① |
近几年流行喝苹果醋,苹果醋是一种由苹果发酵而成的具有解毒、降脂、减肥和止泻等明显药效的健康食品.苹果酸(2-羟基丁二酸)是这种饮料的主要酸性物质,苹果酸的结构简式为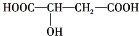 ,下列说法不正确的是( )
,下列说法不正确的是( )
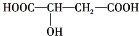 ,下列说法不正确的是( )
,下列说法不正确的是( )| A、苹果酸在一定条件下能发生酯化反应 |
| B、苹果酸在一定条件下能发生催化氧化反应 |
| C、1 mol苹果酸能与2 mol的Na发生反应 |
| D、1 mol苹果酸与Na2CO3溶液反应最多消耗3 mol Na2CO3 |
下列各组离子在溶液中按一定的物质的量之比(见括号)混合,所得溶液为无色透明,且pH>7的是( )
| A、Al3+、Cl-、Na+、CO32-(1:3:2:1) |
| B、HCO3-、K+、H+、I-(1:1:1:1) |
| C、Ca2+、K+、OH-、HCO3-(1:1:1:2) |
| D、NH4+、Ba2+、OH-、Cl- (2:1:2:2) |
