题目内容
硝酸汞和碘化钾溶液混合后会生成红色的碘化汞沉淀,为了探究硝酸汞和碘化钾溶液之间能否发生氧化还原反应,研究人员设计了如图的实验装置,结果电流计指针发生了偏转,下列分析正确的是( )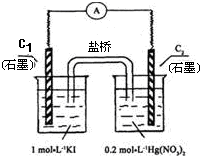

| A、C1电极上发生的反应是:2I--2e-=I2 |
| B、如图装置的电流方向是从C1到C2 |
| C、盐桥中的K+离子向C1电极移动 |
| D、装置发生的总反应是Hg2++2I-=HgI2↓ |
考点:原电池和电解池的工作原理
专题:电化学专题
分析:该装置电流计指针发生了偏转,说明有电流产生,则该装置为原电池,发生氧化还原反应,碘离子易失电子发生氧化反应,所以C1电极为负极、C2电极为正极,负极反应式为2I--2e-=I2,正极反应式为Hg2++e-=Hg+,盐桥中阳离子移向正极、阴离子移向负极,电流从正极沿导线流向负极,据此分析解答.
解答:
解:该装置电流计指针发生了偏转,说明有电流产生,则该装置为原电池,发生氧化还原反应,碘离子易失电子发生氧化反应,所以C1电极为负极、C2电极为正极,
A.C1电极上发生的反应是:2I--2e-=I2,故A正确;
B.电流从正极沿导线流向负极,所以电流方向是从C2到C1,故B错误;
C.盐桥中的K+离子向C2电极移动,故C错误;
D.二者没有直接接触,所以装置发生的总反应是2Hg2++2I-=2Hg++I2,故D错误;
故选A.
A.C1电极上发生的反应是:2I--2e-=I2,故A正确;
B.电流从正极沿导线流向负极,所以电流方向是从C2到C1,故B错误;
C.盐桥中的K+离子向C2电极移动,故C错误;
D.二者没有直接接触,所以装置发生的总反应是2Hg2++2I-=2Hg++I2,故D错误;
故选A.
点评:本题考查原电池原理,明确得失电子的微粒、电流流向、阴阳离子移动方向即可解答,难点是盐桥中阴阳离子移动方向判断.

练习册系列答案
相关题目
某含氧强酸HmXOn,相对分子质量为A,将它溶于水,测得溶液的氢离子浓度为2mol/L,溶液的质量分数为20%,密度为1.5g/cm3,则m值为( )
A、
| ||
B、
| ||
C、
| ||
D、
|
某氯碱厂利用废铁皮制取净水剂FeCl3溶液,最合理的生产途径是( )
A、Cl2
| |||||||||
B、Cl2
| |||||||||
C、Cl2
| |||||||||
D、 |
 如图甲所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光的地方,让混合气体缓慢地反应一段时间.试回答下列问题:
如图甲所示,U形管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混合气体,假定氯气在水中的溶解度可以忽略.将封闭有甲烷和氯气的混合气体的装置放置在有光的地方,让混合气体缓慢地反应一段时间.试回答下列问题: 如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B的分子中共有4个原子,不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为
如图所示的五元环代表A、B、C、D、E五种化合物,圆圈交叉部分指两种化合物含有一种相同元素,五种化合物由五种短周期元素形成,每种化合物仅含两种元素,A是沼气的主要成分,B、E分子中所含电子数均为18,B的分子中共有4个原子,不稳定,具有较强的氧化性,其稀溶液是医疗上广泛使用的消毒剂,E的分子结构模型为 ,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题:
,C、D均为原子晶体,C可作为光导纤维的主要材料,D中所含两种元素的原子个数比为3:4,电子总数之比为3:2.根据以上信息回答下列问题: