题目内容
13.已知热化学方程式:①C2H2(g)+O2(g)═2CO2(g)+H2O(l)△H1=-1301.0kJ•mol-1
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.8kJ•mol-1
则反应④2C(s)+H2(g)═C2H2(g)的△H为( )
| A. | +228.2 kJ•mol-1 | B. | -228.2 kJ•mol-1 | ||
| C. | +1 301.0 kJ•mol-1 | D. | +621.7 kJ•mol-1 |
分析 利用盖斯定律,将②×2+③-①即得到反应④,反应热为△H=2△H2+△H3-△H1,以此解答该题.
解答 解:根据盖斯定律可知,②×2+③-①即得到反应④2C(s)+H2(g)═C2H2(g),所以该反应的△H=-393.5 kJ•mol-1×2-285.8 kJ•mol-1+1301.0 kJ•mol-1=+228.2 kJ•mol-1,故选A.
点评 本题考查反应热的计算,注意根据已知热化学方程式利用盖斯定律计算反应热的方法,答题时注意体会,题目难度不大.

练习册系列答案
相关题目
1.常温下,下列指定溶液中一定能大量共存的是( )
| A. | 无色透明溶液中:K+、Cu2+、SO42-、Na+ | |
| B. | pH=12的溶液中:K+、Na+、SO42-、CH3COO-、CO32- | |
| C. | 加入铝片能放出H2的溶液中:Na+、HCO3-、Cu2+、SO42- | |
| D. | 由水电离出的c(H+)=1×10-12 mol/L的溶液中:NH4+、Ba2+、NO3-、Cl- |
18.有X、Y、Z、M四种金属,已知:M投入水中可与水剧烈反应;用X和Z作电极,稀硫酸作电解质溶液构成原电池时,Z有气泡产生; Y和Z的离子共存于电解液中电解,阴极析出Y.则这四种金属的活动性由强到弱的顺序是( )
| A. | X>Z>Y>M | B. | X>M>Z>Y | C. | M>Y>Z>X | D. | M>X>Z>Y |
5.下列有关说法正确的是( )
| A. | 分子晶体中共价键越强,熔沸点越高 | |
| B. | 只含共价键的物质,一定是共价化合物 | |
| C. | HF的分子间作用力大于HCl,故HF比HCl更稳定 | |
| D. | 分子晶体中,可能不存在共价键,但一定存在分子间作用力 |
3.有关氨及氨水的说法,正确的是( )
| A. | NH3具有还原性 | B. | 液氨、氨气、氨水是同一种物质 | ||
| C. | 氨气是非电解质,氨水是电解质 | D. | 氨水的主要成分是NH3 |
 二甲基亚砜有消炎止痛、镇静等作用.甲醇和硫化氢在γ-Al2O3催化剂作用下
二甲基亚砜有消炎止痛、镇静等作用.甲醇和硫化氢在γ-Al2O3催化剂作用下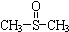 生成甲硫醚(CH3-S-CH3),甲硫醚再与NO2反应制取二甲基亚砜,有关反应如下:
生成甲硫醚(CH3-S-CH3),甲硫醚再与NO2反应制取二甲基亚砜,有关反应如下: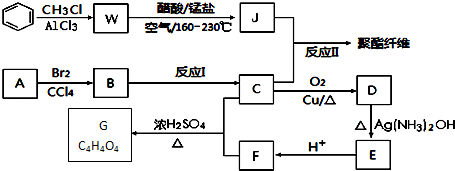
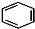 +RCl$\stackrel{AlCl_{3}}{→}$
+RCl$\stackrel{AlCl_{3}}{→}$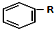 +HCl(-R为烃基)
+HCl(-R为烃基)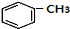 $→_{空气/160-230℃}^{醋酸/锰盐}$
$→_{空气/160-230℃}^{醋酸/锰盐}$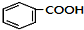
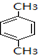 .
. .
.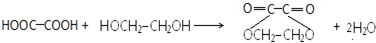 .
.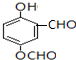 (写出一种即可);
(写出一种即可);