题目内容
18.有X、Y、Z、M四种金属,已知:M投入水中可与水剧烈反应;用X和Z作电极,稀硫酸作电解质溶液构成原电池时,Z有气泡产生; Y和Z的离子共存于电解液中电解,阴极析出Y.则这四种金属的活动性由强到弱的顺序是( )| A. | X>Z>Y>M | B. | X>M>Z>Y | C. | M>Y>Z>X | D. | M>X>Z>Y |
分析 金属越活泼,与水反应越剧烈;一般来说,作原电池负极的金属活动性较强;在电解池中,阴极上氧化性较强的离子先放电,金属离子的氧化性越强,对应的金属单质越不活泼,以此解答该题.
解答 解:M投入水中可与水剧烈反应,说明M最活泼;
用X和ZC作电极,稀硫酸作电解质溶液构成原电池时,Z有气泡产生,Z为正极,说明金属的活动性X>Z;
Y和Z的离子共存于电解液中电解,阴极析出Y,说明金属活动性Z>Y;
则四种金属的活动性由强到弱的顺序是M>X>Z>Y,
故选D.
点评 本题以金属的活动性的比较为载体考查原电池和电解池知识,侧重于电极反应和放电顺序的考查,注意把握原电池和电解池的工作原理,学习中注意相关基础知识的积累,题目难度不大.

练习册系列答案
 高效智能课时作业系列答案
高效智能课时作业系列答案 捷径训练检测卷系列答案
捷径训练检测卷系列答案
相关题目
8.用下列实验仪器或装置进行相应实验,能达到实验目的是( )
| A. |  实验测定氯水的pH | |
| B. | 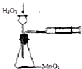 实验定量测定H2O2的分解速率 | |
| C. | 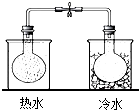 实验中利用NO2颜色的变化验证其中反应的热效应 | |
| D. | 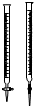 实验中(乙)管内盛放已知浓度的KMnO4溶液来测定FeSO4溶液的浓度 |
9.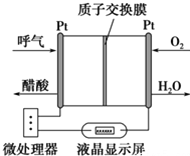 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )
 如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )
如图所示是一种酸性燃料电池酒精检测仪,具有自动吹气流量侦测与控制的功能,非常适合进行现场酒精检测.下列说法不正确的是( )| A. | 该电池的负极反应式为:CH3CH2OH+3H2O-12e-═2CO2↑+12H+ | |
| B. | 该电池的正极反应式为:O2+4e-+4H+═2H2O | |
| C. | 电流由O2所在的铂电极经外电路流向另一电极 | |
| D. | 微处理器通过检测电流大小而计算出被测气体中酒精的含量 |
6.短周期元素的四种离子A2+、B+、C2-、D-具有相同电子层结构,下列叙述正确的是( )
| A. | 原子序数:D>C>B>A | B. | 氢化物的稳定性:H2C>HD | ||
| C. | 离子半径:C2->D->B+>A2+ | D. | 氧化性:A2+>B+,还原性:C2-<D- |
13.已知热化学方程式:
①C2H2(g)+O2(g)═2CO2(g)+H2O(l)△H1=-1301.0kJ•mol-1
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.8kJ•mol-1
则反应④2C(s)+H2(g)═C2H2(g)的△H为( )
①C2H2(g)+O2(g)═2CO2(g)+H2O(l)△H1=-1301.0kJ•mol-1
②C(s)+O2(g)═CO2(g)△H2=-393.5kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O(l)△H3=-285.8kJ•mol-1
则反应④2C(s)+H2(g)═C2H2(g)的△H为( )
| A. | +228.2 kJ•mol-1 | B. | -228.2 kJ•mol-1 | ||
| C. | +1 301.0 kJ•mol-1 | D. | +621.7 kJ•mol-1 |
3.已知在等温、等容条件下,有如下可逆反应:2A(g)+2B(g)?3C(g)+D(g).现分别从两条途径建立平衡,途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度均为6mol/L和2mol/L.下列叙述正确的是( )
| A. | Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的浓度相同 | |
| B. | Ⅰ、Ⅱ两途径最终达到平衡时,体系内混合气体的百分组成相同 | |
| C. | 达到平衡时,Ⅰ途径的反应速率υ1等于Ⅱ途径的反应速率υ2 | |
| D. | 达到平衡时,Ⅰ途径混合气体的密度等于Ⅱ途径混合气体的密度 |
10.将海水淡化和与浓海水资源化结合起来是综合利用海水的重要途径之一.一般是先将海水淡化获得淡水,再从剩余的浓海水中通过一系列工艺提取其他产品.回答下列问题:
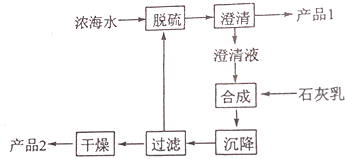
(1)下列改进和优化海水综合利用工艺的设想和做法可行的是②③④(填序号).
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾.溴.镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是:Br2+Na2CO3+H2O→NaBr+NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为$\frac{5}{3}$mol.
(3)海水提镁的一段工艺流程如图:浓海水的主要成分如下:
该工艺过程中,脱硫阶段主要反应的离子方程式为Ca2++SO42-=CaSO4↓,产品2的化学式为Mg(OH)2,1L浓海水最多可得到产品2的质量为69.6g.
(4)采用石墨阳极.不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式Mg+2H2O$\frac{\underline{\;高温\;}}{\;}$Mg(OH)2+H2↑.

(1)下列改进和优化海水综合利用工艺的设想和做法可行的是②③④(填序号).
①用混凝法获取淡水 ②提高部分产品的质量
③优化提取产品的品种 ④改进钾.溴.镁的提取工艺
(2)采用“空气吹出法”从浓海水中吹出Br2,并用纯碱吸收.碱吸收溴的主要反应是:Br2+Na2CO3+H2O→NaBr+NaBrO3+6NaHCO3,吸收1mol Br2时转移的电子为$\frac{5}{3}$mol.
(3)海水提镁的一段工艺流程如图:浓海水的主要成分如下:
| 离子 | Na+ | Mg2+ | Cl- | SO42- |
| 浓度/(g•L-1) | 63.7 | 28.8 | 144.6 | 46.4 |
(4)采用石墨阳极.不锈钢阴极电解熔融的氯化镁,发生反应的化学方程式为MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑电解时,若有少量水存在会造成产品镁的消耗,写出有关反应的化学方程式Mg+2H2O$\frac{\underline{\;高温\;}}{\;}$Mg(OH)2+H2↑.
7.PCl3和PCl5都是重要的化工原料.将PCl3(g)和Cl2(g)充入体积不变的2L密闭容器中,在一定条件下发生反应:PCl3(g)+Cl2(g)?PCl5(g),并于10min时达到平衡.有关数据如下:
下列判断不正确的是( )
| PCl3(g) | Cl2(g) | PCl5(g) | |
| 初始浓度(mol•L-1) | 2.0 | 1.0 | 0 |
| 平衡浓度(mol•L-1) | c1 | c2 | 0.4 |
| A. | 10 min内,v(Cl2)=0.04 mol•L-1•min-1 | |
| B. | 当容器中Cl2为1.2 mol时,反应达到平衡 | |
| C. | 升高温度(T1<T2),反应的平衡常数减小,平衡时PCl3$\frac{△n({T}_{1})}{△n({T}_{2})}$<1 | |
| D. | 平衡后移走2.0 mol PCl3和1.0 mol Cl2,在相同条件再达平衡时,c(PCl5)<0.2 mol•L-1 |
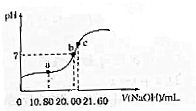 草酸(H2C2O4,二元酸弱)与草酸盐在实验和工业生产中都起着重要的作用.
草酸(H2C2O4,二元酸弱)与草酸盐在实验和工业生产中都起着重要的作用.