题目内容
下列中的实验一定不会出现沉淀现象的是( )
| A、CO2气体通入NaAlO2溶液中 |
| B、SO2气体通入BaCl2溶液中 |
| C、CO2气体通入饱和Na2CO3溶液中 |
| D、SO2气体通入Ba(OH)2溶液中 |
考点:镁、铝的重要化合物,二氧化硫的化学性质,钠的重要化合物
专题:元素及其化合物
分析:A、根据二氧化碳通入NaAlO2溶液中生成氢氧化铝沉淀分析;
B、SO2溶于水生成的H2SO3是弱酸,不会与强酸的钡盐发生复分解反应;
C、根据碳酸钠溶解度大于碳酸氢钠的进行分析;
D、SO2是酸性氧化物,少量二氧化硫通入氢氧化钡溶液生成亚硫酸钡沉淀,继续通入沉淀溶解.
B、SO2溶于水生成的H2SO3是弱酸,不会与强酸的钡盐发生复分解反应;
C、根据碳酸钠溶解度大于碳酸氢钠的进行分析;
D、SO2是酸性氧化物,少量二氧化硫通入氢氧化钡溶液生成亚硫酸钡沉淀,继续通入沉淀溶解.
解答:
解:A、NaAlO2溶液中通入足量CO2,反应生成氢氧化铝沉淀,发生NaAlO2+CO2+2H2O═Al(OH)3↓+NaHCO3,故A不符合;
B、SO2溶于水生成的H2SO3是弱酸,因为弱酸不能制强酸,SO2不能和BaCl2发生反应,所以不会出现沉淀,故B符合;
C、饱和Na2CO3溶液中通入足量CO2反应生成碳酸氢钠,碳酸氢钠的溶解度小,因此会析出晶体,溶液变浑浊,发生Na2CO3+CO2+H2O═2NaHCO3↓,故C不符合;
D、SO2是酸性氧化物,少量二氧化硫通入氢氧化钡溶液生成亚硫酸钡沉淀,继续通入沉淀溶解,故D不符合.
故选B.
B、SO2溶于水生成的H2SO3是弱酸,因为弱酸不能制强酸,SO2不能和BaCl2发生反应,所以不会出现沉淀,故B符合;
C、饱和Na2CO3溶液中通入足量CO2反应生成碳酸氢钠,碳酸氢钠的溶解度小,因此会析出晶体,溶液变浑浊,发生Na2CO3+CO2+H2O═2NaHCO3↓,故C不符合;
D、SO2是酸性氧化物,少量二氧化硫通入氢氧化钡溶液生成亚硫酸钡沉淀,继续通入沉淀溶解,故D不符合.
故选B.
点评:本题考查了物质性质的应用,物质反应的产物和现象,熟练掌握物质性质是解题关键,题目难度中等.

练习册系列答案
 仁爱英语同步练习册系列答案
仁爱英语同步练习册系列答案 学习实践园地系列答案
学习实践园地系列答案
相关题目
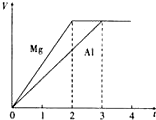 镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的( )
镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图.反应中镁和铝的( )| A、物质的量之比为3:2 |
| B、质量之比为3:2 |
| C、摩尔质量之比为2:3 |
| D、单位时间内生成H2的体积之比为2:3 |
下列说法中不正确的是( )
①实验室制Fe(OH)2时应将装有NaOH溶液的胶头滴管伸入FeSO4溶液液面下,缓缓挤出碱液
②玛瑙手镯、水晶项链、餐桌上的陶瓷碗盘都是硅酸盐制品
③二氧化硅晶体广泛用于制作太阳能电池和光导纤维
④制造水泥、玻璃的原料都有石灰石、纯碱、石英
⑤二氧化硅既能与氢氟酸反应,又能与烧碱反应,所以它是两性氧化物
⑥粗硅制备单晶硅涉及氧化还原反应.
①实验室制Fe(OH)2时应将装有NaOH溶液的胶头滴管伸入FeSO4溶液液面下,缓缓挤出碱液
②玛瑙手镯、水晶项链、餐桌上的陶瓷碗盘都是硅酸盐制品
③二氧化硅晶体广泛用于制作太阳能电池和光导纤维
④制造水泥、玻璃的原料都有石灰石、纯碱、石英
⑤二氧化硅既能与氢氟酸反应,又能与烧碱反应,所以它是两性氧化物
⑥粗硅制备单晶硅涉及氧化还原反应.
| A、全正确 | B、①②③④⑥ |
| C、②③④⑤ | D、③④⑤ |
下列各组中的离子,能在溶液中大量共存的是( )
| A、Cu2+、Ba2+、C1-、SO42- |
| B、K+、Na+、OH-、C1- |
| C、Na+、H+、SO42-、OH- |
| D、H+、Na+、Cl-、CO32- |
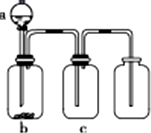 用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂,且尾气处理装置略),其中可行的是( )
用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂,且尾气处理装置略),其中可行的是( ) 现有 D、E、F六种物质,其中A、B、C是由短周期元素组成的常见单质,D分子含有10个电子,F是一种不含金属元素的盐.一定条件下转化关系如下:请回答:
现有 D、E、F六种物质,其中A、B、C是由短周期元素组成的常见单质,D分子含有10个电子,F是一种不含金属元素的盐.一定条件下转化关系如下:请回答: