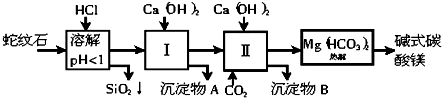
题目内容
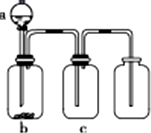 用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂,且尾气处理装置略),其中可行的是( )
用如图所示装置制取、提纯并收集表中的四种气体(a、b、c表示相应仪器中加入的试剂,且尾气处理装置略),其中可行的是( )| 气体 | a | b | c | |
| A | NO2 | 浓硝酸 | 铜片 | 浓硫酸 |
| B | SO2 | 浓硫酸 | Cu | 酸性KMnO4溶液 |
| C | CO2 | 稀硫酸 | CaCO3 | 浓硫酸 |
| D | NH3 | 浓氨水 | 生石灰 | 浓硫酸 |
| A、A | B、B | C、C | D、D |
考点:实验装置综合
专题:实验设计题
分析:由图可知,图中装置为固体与液体反应不需要加热制备气体,c为除杂装置,最后利用向上排空气法收集,以此来解答.
解答:
解:A.Cu与浓硝酸不需要加热生成的二氧化氮可利用向上排空气法收集,故A正确;
B.Cu与浓硫酸反应需要加热,故B错误;
C.稀硫酸与碳酸钙反应生成硫酸钙包裹在碳酸钙的表面,阻止反应的发生,则不适合制备气体,故C错误;
D.氨气不能利用浓硫酸干燥,故D错误;
故选A.
B.Cu与浓硫酸反应需要加热,故B错误;
C.稀硫酸与碳酸钙反应生成硫酸钙包裹在碳酸钙的表面,阻止反应的发生,则不适合制备气体,故C错误;
D.氨气不能利用浓硫酸干燥,故D错误;
故选A.
点评:本题考查常见气体的制备实验及实验装置的综合,为高频考点,把握制备原理及实验装置的作用为解答的关键,侧重分析与实验能力的考查,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
能用溴水鉴别的是( )
| A、甲烷、乙烯 |
| B、甲烷、乙烷 |
| C、NaCl溶液、KCl溶液 |
| D、MgSO4溶液、Mg(NO3)2溶液 |
下列有机物中,属于高分子化合物的是( )
| A、油脂 | B、蔗糖 |
| C、葡萄糖 | D、蛋白质 |
下列中的实验一定不会出现沉淀现象的是( )
| A、CO2气体通入NaAlO2溶液中 |
| B、SO2气体通入BaCl2溶液中 |
| C、CO2气体通入饱和Na2CO3溶液中 |
| D、SO2气体通入Ba(OH)2溶液中 |

 )和阿司匹林有相似的结构,它的一种制备方法如下
)和阿司匹林有相似的结构,它的一种制备方法如下
 与足量的氢溴酸在加热条件下反应的化学方程式为
与足量的氢溴酸在加热条件下反应的化学方程式为