题目内容
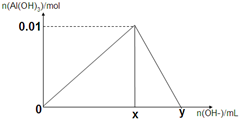 将3mol/L NaOH溶液滴入到25mL一定浓度的AlCl3溶液中.如图是整个过程的数学分析曲线.其中横轴表示加入OH-的体积,纵轴表示产生的Al(OH)3沉淀物质的量.据图示回答下列问题:
将3mol/L NaOH溶液滴入到25mL一定浓度的AlCl3溶液中.如图是整个过程的数学分析曲线.其中横轴表示加入OH-的体积,纵轴表示产生的Al(OH)3沉淀物质的量.据图示回答下列问题:①写出0-x段发生的反应的离子方程式:
②c(AlCl3)=
③x=
考点:化学方程式的有关计算
专题:计算题
分析:①0-x段发生的反应:Al3++3OH-=Al(OH)3↓;x-y段发生的反应:Al(OH)3+OH-═AlO2-+H2O;
②根据Al元素守恒:n(AlCl3)=n[Al(OH)3],再根据c=
计算c(AlCl3);
③根据方程式计算两阶段消耗NaOH物质的量,再根据V=
计算解答.
②根据Al元素守恒:n(AlCl3)=n[Al(OH)3],再根据c=
| n |
| V |
③根据方程式计算两阶段消耗NaOH物质的量,再根据V=
| n |
| c |
解答:
解:①0-x段发生的反应:Al3++3OH-=Al(OH)3↓;x-y段发生的反应:Al(OH)3+OH-═AlO2-+H2O,
故答案为:Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-═AlO2-+H2O;
②根据Al元素守恒:n(AlCl3)=n[Al(OH)3]=0.01mol,则c(AlCl3)=
=0.4mol/L,
故答案为:0.4;
③由Al3++3OH-=Al(OH)3↓可知,氢氧化铝沉淀最大时,消耗NaOH为0.01mol×3=0.03mol,该阶段消耗NaOH溶液体积为
=0.01L=10mL,即x=10;
由Al(OH)3+OH-═AlO2-+H2O 可知,溶解氢氧化铝消耗NaOH为0.01mol,该解答消耗NaOH溶液体积为
=0.0033L=3.3mL,即y=10+3.3=13.3,
故答案为:10;13.3.
故答案为:Al3++3OH-=Al(OH)3↓;Al(OH)3+OH-═AlO2-+H2O;
②根据Al元素守恒:n(AlCl3)=n[Al(OH)3]=0.01mol,则c(AlCl3)=
| 0.01mol |
| 0.025L |
故答案为:0.4;
③由Al3++3OH-=Al(OH)3↓可知,氢氧化铝沉淀最大时,消耗NaOH为0.01mol×3=0.03mol,该阶段消耗NaOH溶液体积为
| 0.03mol |
| 3mol/L |
由Al(OH)3+OH-═AlO2-+H2O 可知,溶解氢氧化铝消耗NaOH为0.01mol,该解答消耗NaOH溶液体积为
| 0.01mol |
| 3mol/L |
故答案为:10;13.3.
点评:本题以化学反应图象为载体,考查化学方程式有关计算,难度不大,明确发生的反应是关键.

练习册系列答案
相关题目
除去镁粉中的少量铝粉,可选用( )
| A、硫酸 | B、氨水 |
| C、盐酸 | D、氢氧化钠溶液 |
合成氨所需的氢气可用煤和水作原料经多步反应制得,其中的一步反应为:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0,反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
| A、增大CO的浓度 | B、降低温度 |
| C、升高温度 | D、增大压强 |
下列叙述中正确的是( )
| A、原电池跟电解池连接后,电子从电池负极流向电解池阳极 |
| B、合成氨生产过程中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| C、无隔膜电解饱和NaCl溶液所得产物之一是“84”消毒液中的有效成分 |
| D、工业上铜的电解精炼时电解池中每转移1mol电子时阴极析出的铜小于0.5NA |
下列有关金属及其合金的说法正确的是( )
| A、地壳中含量最多的金属元素是铁 |
| B、合金与各组分金属相比一般具有更低的熔点 |
| C、生铁、普通钢和不锈钢中的碳含量依次增加 |
| D、在化学反应中金属失电子,被还原 |
下列说法正确的是( )
| A、干粉(含NaHCO3)灭火剂能扑灭钠着火 |
| B、Na2O2中阳离子和阴离子的个数比为1:1 |
| C、Na2CO3和NaHCO3都能跟CaCl2溶液反应得到白色沉淀 |
| D、物质灼烧时焰色反应为黄色,该物质一定含有钠元素 |
下列各组离子,在强碱性无色溶液中可以大量共存的是( )
| A、Na+、Ba2+、Cl-、SO42- |
| B、Cu2+、Ba2+、AlO2-、NO3- |
| C、NH4+、K+、Cl-、NO3- |
| D、Na+、K+、NO3-、SiO32- |
下列各组离子在指定条件下,一定能大量共存的是( )
| A、pH为1的无色溶液:K+、Fe2+、SO32-、Cl- |
| B、能使碘化钾淀粉试纸变蓝的溶液:Na+、NH4+、S2-、Br- |
| C、水电离出的c(H+)=10-12mol/L的溶液:Ba2+、Na+、NO3-、Cl- |
| D、加入铝条有氢气放出的溶液:Na+、NH4+、HCO3-、SO42- |