题目内容
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
| B、1 mol Na202固体中含离子总数为4NA |
| C、标准状况下,11.2L苯中含有分子的数目为0.5NA |
| D、在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、依据元素守恒计算得到氧原子数;
B、过氧化钠是钠离子和过氧根离子构成;
C、苯标准状况不是气体;
D、过氧化钠和水反应每生成1mol氧气电子转移2mol.
B、过氧化钠是钠离子和过氧根离子构成;
C、苯标准状况不是气体;
D、过氧化钠和水反应每生成1mol氧气电子转移2mol.
解答:
解:A、依据元素守恒计算得到氧原子数=
×NA=0.1NA,故A正确;
B、过氧化钠是钠离子和过氧根离子构成,1 mol Na202固体中含离子总数为3NA,故B错误;
C、苯标准状况不是气体,11.2L苯物质的量不是0.5mol,故C错误;
D、过氧化钠和水反应每生成1mol氧气电子转移2mol,每生成0.1mol氧气,转移电子的数目为0.2NA,故D错误;
故选A.
| 1.6g |
| 16g/mol |
B、过氧化钠是钠离子和过氧根离子构成,1 mol Na202固体中含离子总数为3NA,故B错误;
C、苯标准状况不是气体,11.2L苯物质的量不是0.5mol,故C错误;
D、过氧化钠和水反应每生成1mol氧气电子转移2mol,每生成0.1mol氧气,转移电子的数目为0.2NA,故D错误;
故选A.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积概念的分析和条件应用,物质结构的理解掌握和氧化还原反应电子转移计算,题目较简单.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
分子式为C8H10O的同分异构体中,属于芳香醇且其催化氧化产物能发生银镜反应的有( )
| A、3种 | B、4种 | C、5种 | D、6种 |
如图是部分短周期元素最外层电子数与原子序数的关系图,下列说法正确的是( )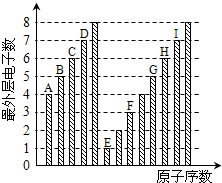

| A、原子半径:A<B<C<D |
| B、E和C元素形成的化合物中只可能存在离子键 |
| C、气态氢化物稳定性:I>D>H>G |
| D、E、F和H三种元素相应的最高价氧化物对应水化物之间两两会发生反应 |
用NA表示阿伏加德罗常数的值,下列说法正确的是l相对原子质量:C-12N-14O-16( )
| A、0.1mol/L稀盐酸中,Cl-数为0.1NA |
| B、2.24 L NH3中含N-H键数目为0.3NA |
| C、2.8g N2和2.8g CO所含分子数均为0.1NA |
| D、0.lmol H2O2完全分解转移的电子数为0.2NA |
化学在生产和日常生活中有着重要的应用.下列叙述正确的是( )
| A、氯气是合成塑料、橡胶、农药和制盐酸、有机溶剂的重要原料 |
| B、“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 |
| C、白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去 |
| D、“雾霾天气”、“温室效应”、“光化学烟雾”的形成都与氮氧化物无关 |
中学化学课本中有大量的数据资料.下面是某学生对数据的利用.其中不正确的是( )
| A、利用相对分子质量大小可以判断某些物质的熔沸点高低 |
| B、利用密度数据可判断液体物质挥发性的大小 |
| C、利用原子(或离子)半径数据可推断某些原子(或离子)的氧化性和还原性的强弱 |
| D、利用溶解度数据可推测将一些物质混合物分离开来的可能性 |
下列物质的颜色是白色的是( )
| A、Cu2O |
| B、CuO |
| C、CuSO4 |
| D、Na2O2 |
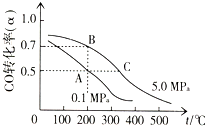 科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,产出了高热值的煤炭气,主要成分是CO和H2.
科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,产出了高热值的煤炭气,主要成分是CO和H2.