题目内容
(1)同温同压下,同体积的N2和SO2原子总数之比为 ,质量之比为 ,密度之比为 .
(2)取1.43g Na2CO3?10H2O溶于水配成100ml溶液,
①Na2CO3物质的量浓度 ;
②Na+ 物质的量浓度 ;
③取出20ml该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.04mol/L,求加入蒸馏水的体积 (假设稀释时,对溶液体积的影响忽略不计).
(2)取1.43g Na2CO3?10H2O溶于水配成100ml溶液,
①Na2CO3物质的量浓度
②Na+ 物质的量浓度
③取出20ml该溶液用蒸馏水稀释,使Na2CO3溶液物质的量浓度变为0.04mol/L,求加入蒸馏水的体积
考点:物质的量的相关计算
专题:
分析:(1)同温同压下,同体积的气体具有相同的分子数,则具有相同的物质的量,再利用构成来分析原子数,利用m=n×M来分析质量,由pM=ρRT可知,密度之比等于摩尔质量之比.
(2)①根据n=
计算Na2CO3?10H2O的物质的量,碳酸钠与Na2CO3?10H2O的物质的量相等,根据c=
计算溶液物质的量浓度;
②溶液中c(Na+)=2c(Na2CO3);
③根据稀释定律计算稀释后溶液的体积,进而计算加入水的体积.
(2)①根据n=
| m |
| M |
| n |
| V |
②溶液中c(Na+)=2c(Na2CO3);
③根据稀释定律计算稀释后溶液的体积,进而计算加入水的体积.
解答:
解:(1)因同温同压下,同体积的气体具有相同的分子数,则具有相同的物质的量,
则N2和SO2分子数之比为1:1,原子总数之比为1×2:1×3=2:3,质量之比为1×28:1×64=7:16,
又由pM=ρRT可知,同温同压下气体的密度之比等于摩尔质量之比,摩尔质量之比为28g/mol:64g/mol=7:16,则密度之比为7:16,
故答案为:2:3;7:16;7:16;
(2)①2.86gNa2CO3?10H2O的物质的量=
=0.005mol,溶于水配成100ml溶液,碳酸钠与Na2CO3?10H2O的物质的量相等,溶液物质的量浓度=
=0.05mol/L,
故答案为:0.05mol/L;
②溶液中c(Na+)=2c(Na2CO3)=2×0.05mol/L=0.1mol/L,
故答案为:0.1mol/L;
③根据稀释定律,稀释后溶液的体积=
=25mL,则加入水的体积=25mL-20mL=5mL,
故答案为:5 mL.
则N2和SO2分子数之比为1:1,原子总数之比为1×2:1×3=2:3,质量之比为1×28:1×64=7:16,
又由pM=ρRT可知,同温同压下气体的密度之比等于摩尔质量之比,摩尔质量之比为28g/mol:64g/mol=7:16,则密度之比为7:16,
故答案为:2:3;7:16;7:16;
(2)①2.86gNa2CO3?10H2O的物质的量=
| 1.43g |
| 286g/mol |
| 0.005mol |
| 0.1L |
故答案为:0.05mol/L;
②溶液中c(Na+)=2c(Na2CO3)=2×0.05mol/L=0.1mol/L,
故答案为:0.1mol/L;
③根据稀释定律,稀释后溶液的体积=
| 20mL×0.05mol/L |
| 0.04mol/L |
故答案为:5 mL.
点评:本题考查阿伏伽德罗定律及其推论,物质的量浓度有关计算,比较基础,注意对公式的理解与灵活应用.明确相同温度和压强下气体的体积与物质的量的关系及物质的构成即可解答,并应熟悉常见气体的摩尔质量来解答.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列生活中的化学的说法,不正确的是( )
| A、用热的纯碱可除去炊具上的油污 |
| B、福尔马林可制备标本是利用了使蛋白质变性的性质 |
| C、含钙、钡等金属元素的物质有绚丽的颜色,可用于制造焰火 |
| D、红葡萄酒储藏时间长后变香是因为乙醇发生了酯化反应 |
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、酸性溶液中:Na+、K+、Fe3+、ClO- |
| B、溶液c(OH-)=10-12mol/L:NH4+、Al3+、NO3-、Cl- |
| C、某透明溶液:MnO4-、Mg2+、SO42-、Na+ |
| D、能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- |
按图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)( )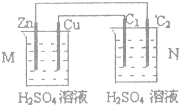

| A、C1上发生还原反应 |
| B、M装置中SO2-4移向Cu电极 |
| C、工作一段时间后装置M中溶液PH变大,装置N中溶液PH变小 |
| D、Cu电极与C2电极上的电极反应不同 |
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
| B、1 mol Na202固体中含离子总数为4NA |
| C、标准状况下,11.2L苯中含有分子的数目为0.5NA |
| D、在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
去年年末,今年年初我国多省市遭遇雾霾笼罩,“PM2.5”数据监测纳入公众视野.“PM2.5”是指大气中直径小于或等于2.5微米的细小颗粒物,也称为可入肺颗粒物.下列有关说法中,错误的是( )
| A、雾霾有可能产生丁达尔现象 |
| B、城市由于汽车尾气的大量排放,比农村形成雾霾天气的可能性更大 |
| C、氟利昂作制冷剂会加剧雾霾天气的形成 |
| D、雾霾天气严重危害人体健康 |
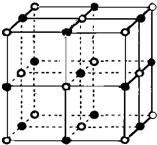 决定物质性质的重要因素是物质结构.请回答下列问题.
决定物质性质的重要因素是物质结构.请回答下列问题.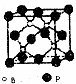 硼是新型无机材料中的明星元素.
硼是新型无机材料中的明星元素.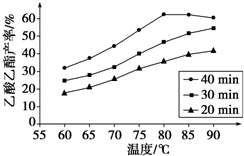 工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯:
工业上常利用醋酸和乙醇合成有机溶剂乙酸乙酯: