题目内容
如图是部分短周期元素最外层电子数与原子序数的关系图,下列说法正确的是( )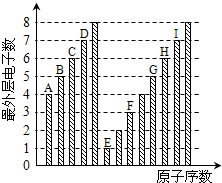

| A、原子半径:A<B<C<D |
| B、E和C元素形成的化合物中只可能存在离子键 |
| C、气态氢化物稳定性:I>D>H>G |
| D、E、F和H三种元素相应的最高价氧化物对应水化物之间两两会发生反应 |
考点:原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:都是短周期元素,由最外层电子数与原子序数关系可知,A、B、C、D处于第二周期,A的最外层电子数为4,故A为碳元素,依此类推B、C、D分别为氮、氧、氟元素;E、F、G、H、I处于第三周期,最外层电子数分别为1、3、5、6、7,故E为Na元素、F为Al元素、G为P元素、H为S元素、I为Cl元素,结合对应单质、化合物的性质以及元素周期律知识解答该题.
解答:
解:A.电子层数越多半径越大,电子层相同时,核电荷数越多半径越小,原子半径大小顺序为A>B>C>D,故A错误;
B.E和C元素形成的化合物过氧化钠中存在过氧非极性共价键,故B错误;
C.气态氢化物稳定性,中心元素的非金属性越强,对应氢化物越稳定,非金属性F>Cl,气态氢化物稳定性F>Cl,故C错误;
D.E、F和H三种元素相应的最高价氧化物对应水化物分别是氢氧化钠,氢氧化铝和硫酸,三者之间两两会发生反应,故D正确;
故选D.
B.E和C元素形成的化合物过氧化钠中存在过氧非极性共价键,故B错误;
C.气态氢化物稳定性,中心元素的非金属性越强,对应氢化物越稳定,非金属性F>Cl,气态氢化物稳定性F>Cl,故C错误;
D.E、F和H三种元素相应的最高价氧化物对应水化物分别是氢氧化钠,氢氧化铝和硫酸,三者之间两两会发生反应,故D正确;
故选D.
点评:本题考查原子结构与元素周期律知识,为高考常见题型和高频考点,侧重于学生的分析能力的考查,根据最外层电子数及原子序数的关系确定元素是解题的关键,注意整体把握元素周期表的结构,难度中等.

练习册系列答案
相关题目
铝能用来冶炼难熔金属(如Fe、V、Mn等),这是因为铝有( )
| A、两性 |
| B、良好导电性 |
| C、熔点低 |
| D、还原性,在反应中放出大量热 |
按图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)( )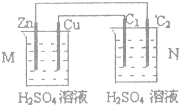

| A、C1上发生还原反应 |
| B、M装置中SO2-4移向Cu电极 |
| C、工作一段时间后装置M中溶液PH变大,装置N中溶液PH变小 |
| D、Cu电极与C2电极上的电极反应不同 |
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
| B、1 mol Na202固体中含离子总数为4NA |
| C、标准状况下,11.2L苯中含有分子的数目为0.5NA |
| D、在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是( )
| A、升高温度 |
| B、加入适量的水 |
| C、加入少量CuSO4溶液 |
| D、加入浓度较大的盐酸 |