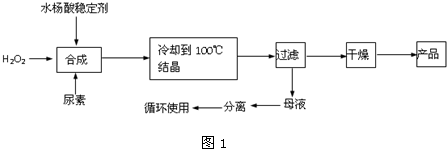
题目内容
 科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,产出了高热值的煤炭气,主要成分是CO和H2.
科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,产出了高热值的煤炭气,主要成分是CO和H2.(1)已知:C(s)+O2(g)=CO2(g)△H1=-393.5kJ?mol-1①
2H2(g)+O2(g)=2H2O(g)△H2=-483.6kJ?mol-1②
C(s)+H2O(g)=CO(g)+H2(g)△H3=+131.3kJ?mol-1③
①反应CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g),△H=
②标准状况下33.6L煤炭气(CO、H2)与氧气完全反应生成CO2和H2O,反应过程中转移
(2)某种熔融盐燃料电池,两电极分别通煤炭气(CO、H2)、空气与CO2的混合气体,Li2CO3和Na2CO3混合物做电解质.若负极的气体按物质的量之比为1:1参与反应,该电极反应式为
(3)恒容密闭容器中充有10mol CO与20mol H2,在催化剂作用下反应生成甲醇:
CO(g)+2H2(g)?CH3OH(g);
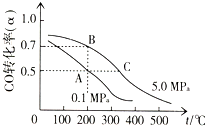
CO的平衡转化率(α)与温度、压强的关系如图所示.
①若在A点时容器的体积为VAL,则该温度下的平衡常数K=
②自反应开始到达平衡状态所需的时间tA
③在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是
考点:热化学方程式,化学电源新型电池,化学平衡的影响因素,化学平衡的计算
专题:基本概念与基本理论
分析:(1)依据热化学方程式和盖斯定律来计算得到;依据n=
计算物质的量结合化学方程式的电子转移计算;
(2)该燃料电池中,负极上一氧化碳、氢气失电子和碳酸根离子反应生成二氧化碳和水;
(3)①A、B点是同温度下的平衡,转化率变化,但平衡常数不变,根据A点温度下的转化率求平衡时各种物质的浓度,依据平衡常数概念计算得到;
②C点温度高速率达,达到平衡所需要的时间短;
③提高CO的转化率可采取的措施是改变条件促使平衡正向进行.
| V |
| 22.4 |
(2)该燃料电池中,负极上一氧化碳、氢气失电子和碳酸根离子反应生成二氧化碳和水;
(3)①A、B点是同温度下的平衡,转化率变化,但平衡常数不变,根据A点温度下的转化率求平衡时各种物质的浓度,依据平衡常数概念计算得到;
②C点温度高速率达,达到平衡所需要的时间短;
③提高CO的转化率可采取的措施是改变条件促使平衡正向进行.
解答:
解:(1)C(s)+O2(g)=CO2(g)△H1=-393.5kJ/mol①
C(s)+H2O(g)=CO(g)+H2(g)△H2=+131.3kJ/mol③
由盖斯定律①-③得到CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H=-524.8KJ/mol;
在标准状况下,33.6L的煤炭合成气物质的量为1.5mol,与氧气完全反应生成CO2和H2O,反应过程中2mol合成气完全反应电子转移4mol,所以1.5mol合成气反应转移电子3mol;
故答案为:-524.8;3;
(2)该燃料电池中,负极的气体按物质的量之比为1:1参与反应,则负极上一氧化碳、氢气失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为CO+H2-4e-+2CO32-=3CO2+H2O,
故答案为:CO+H2-4e-+2CO32-=3CO2+H2O;
(3)①依据图象分析可知AB是同温度下的平衡,平衡常数随温度变化,所以平衡常数不变;
CO(g)+2H2(g)?CH3OH(g)
初起浓度
mol/L
mol/L 0
变化量
mol/L
mol/L
mol/L
平衡量
mol/L
mol/L
mol/L
故K=
L2?mol-2,
故答案为:
L2?mol-2;
②达到A、C两点的平衡状态所需的时间,C点温度高反应速率快达到反应速率需要的时间短,tA>tC,故答案为:大于;
③反应是气体体积减小的放热反应,提高CO的转化率可采取的措施是降温、加压、分离出甲醇,故答案为:降温、加压、将甲醇从混合体系中分离出来.
C(s)+H2O(g)=CO(g)+H2(g)△H2=+131.3kJ/mol③
由盖斯定律①-③得到CO(g)+H2(g)+O2(g)=H2O(g)+CO2(g)△H=-524.8KJ/mol;
在标准状况下,33.6L的煤炭合成气物质的量为1.5mol,与氧气完全反应生成CO2和H2O,反应过程中2mol合成气完全反应电子转移4mol,所以1.5mol合成气反应转移电子3mol;
故答案为:-524.8;3;
(2)该燃料电池中,负极的气体按物质的量之比为1:1参与反应,则负极上一氧化碳、氢气失电子和碳酸根离子反应生成二氧化碳和水,电极反应式为CO+H2-4e-+2CO32-=3CO2+H2O,
故答案为:CO+H2-4e-+2CO32-=3CO2+H2O;
(3)①依据图象分析可知AB是同温度下的平衡,平衡常数随温度变化,所以平衡常数不变;
CO(g)+2H2(g)?CH3OH(g)
初起浓度
| 10 |
| Va |
| 20 |
| Va |
变化量
| 5 |
| Va |
| 10 |
| Va |
| 5 |
| Va |
平衡量
| 5 |
| Va |
| 10 |
| Va |
| 5 |
| Va |
故K=
| ||||
|
故答案为:
| Va2 |
| 100 |
②达到A、C两点的平衡状态所需的时间,C点温度高反应速率快达到反应速率需要的时间短,tA>tC,故答案为:大于;
③反应是气体体积减小的放热反应,提高CO的转化率可采取的措施是降温、加压、分离出甲醇,故答案为:降温、加压、将甲醇从混合体系中分离出来.
点评:本题考查了热化学方程式和盖斯定律的计算应用,化学平衡标志判断,图象分析,影响平衡的因素分析判断,化学平衡移动原理是解题关键,题目难度中等.

练习册系列答案
相关题目
下列有关生活中常见有机物的说法正确的是( )
| A、甲烷和氯气在光照条件下发生取代反应,产物是气体与液体的混合物 |
| B、液化石油气和天然气的主要成分都是甲烷 |
| C、苯和乙烯都能使溴水层变为无色,二者都发生加成反应 |
| D、煤干馏可得煤油,甲烷、乙烯和苯都能从石油中分馏得到 |
铝能用来冶炼难熔金属(如Fe、V、Mn等),这是因为铝有( )
| A、两性 |
| B、良好导电性 |
| C、熔点低 |
| D、还原性,在反应中放出大量热 |
常温下,下列各组离子在指定溶液中能大量共存的是( )
| A、酸性溶液中:Na+、K+、Fe3+、ClO- |
| B、溶液c(OH-)=10-12mol/L:NH4+、Al3+、NO3-、Cl- |
| C、某透明溶液:MnO4-、Mg2+、SO42-、Na+ |
| D、能使淀粉碘化钾试纸显蓝色的溶液:K+、SO42-、S2-、SO32- |
按图装置进行实验,下列描述正确的是(N装置中两个电极均为石墨棒)( )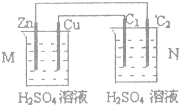

| A、C1上发生还原反应 |
| B、M装置中SO2-4移向Cu电极 |
| C、工作一段时间后装置M中溶液PH变大,装置N中溶液PH变小 |
| D、Cu电极与C2电极上的电极反应不同 |
设NA为阿伏伽德罗常数的值.下列说法正确的是( )
| A、1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA |
| B、1 mol Na202固体中含离子总数为4NA |
| C、标准状况下,11.2L苯中含有分子的数目为0.5NA |
| D、在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子的数目为0.4NA |
化学方程式是一种重要的化学用语.下列化学方程式(或离子方程式)不能用来正确解释化学过程或事实的是( )
A、铝热反应制取金属钨:WO3+2Al
| ||||
| B、红热的铁丝与水接触,表面形成蓝黑色(或黑色)保护层:3Fe+4H2O(g)═Fe3O4+4H2 | ||||
| C、“84消毒液”(有效成分NaClO)和“洁厕灵”(主要成分盐酸)混合使用时会放出氯气:ClO-+Cl-+2H+=Cl2↑+H2O | ||||
| D、在海带灰的浸出液(含有I-)中滴加H2O2得到I2:2I-+3H2O2+2H+=I2+O2↑+4H2O |