题目内容
16. 某研究性学习小组设计了一组实验探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用图装置完成了O元素的非金属性比S强的实验研究.回答下列问题:
某研究性学习小组设计了一组实验探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用图装置完成了O元素的非金属性比S强的实验研究.回答下列问题:(1)图中D装置在实验中的作用是防倒吸.
(2)从以下所给物质中选出甲同学设计的实验所用到物质,图中试剂A为①
①稀HNO3溶液 ②稀盐酸 ③稀醋酸 ④稀硫酸
写出试管C中气体少量时发生反应的离子方程式SiO32-+CO2+H2O═H2SiO3↓+CO32-.
(3)乙同学设计的实验所用到试剂试剂B为二氧化锰,试剂C为H2S.那么A为双氧水;C处的现象为浅黄色沉淀产生;写出C中发生反应的化学方程式为2H2S+O2=2S↓+2H2O.
分析 (1)装置图中D的上端体积较大,可以防倒吸;
(2)装置中为强酸制备弱酸依此选择试剂,C中为二氧化碳与硅酸钠溶液的反应;
(3)通过比较单质的氧化性来判断非金属性,氧气与硫化氢反应生成硫沉淀.
解答 解:(1)由装置图可知,装置图中D的上端体积较大,可以防倒吸;
故答案为:防倒吸;
(2)通过比较酸性强弱来判断非金属性强弱,装置中为强酸制备弱酸,所以A中试剂为稀硝酸,B中为碳酸钙,C中为Na2SiO3溶液,试管C中为二氧化碳与硅酸钠溶液的反应,其离子方程式为:SiO32-+CO2+H2O═H2SiO3↓+CO32-;
故答案为:①;SiO32-+CO2+H2O═H2SiO3↓+CO32-;
(3)完成了O元素的非金属性比S强的实验研究,通过比较单质的氧化性来判断非金属性,所以用二氧化锰作催化剂使双氧水分解生成氧气,氧气通过氢硫酸或硫化钠溶液会生成硫单质,其反应的方程式为:2H2S+O2=2S↓+2H2O;
故答案为:双氧水;2H2S+O2=2S↓+2H2O.
点评 本题考查了元素非金属性强弱的比较,侧重于考查学生的实验探究能力,题目难度中等,明确实验原理、非金属性的比较方法是解题的关键.

练习册系列答案
相关题目
6.下列叙述的有机物分子中不含有官能团的是( )
| A. | 乙烯与氢气反应后的产物 | |
| B. | 甲苯与浓硫酸、浓硝酸60℃加热后生成的有机物 | |
| C. | 苯与液溴、还原铁粉混合后生成的有机物 | |
| D. | 甘油 |
7.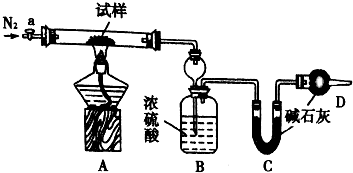 小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•l0H2O,为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如图装置进行实验.
小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•l0H2O,为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如图装置进行实验.
实验过程:
I.按图组装仪器,检查装置的气密性;
II.将m1 g试样放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量为m2g、装置C的质量为m3 g;
Ⅲ,关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;Ⅳ.称得装置B的质量为m4g、装置C的质量为m5g.
请回答以下问题(装置中原有空气对实验的影响忽略不计):
(1)装置A中发生反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;Na2CO3•10H2O$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+10H2O.
(2)装置B的作用为吸收反应生成的水蒸气.装置C的作用为吸收反应生成的二氧化碳.
(3)实验过程中通入N2的目的为使装置中的二氧化碳和水蒸气全部排出被装置BC全部吸收.
(4)用下列各项所提供的数据能计算出NaHCO3的质量分数w(NaHCO3)的是bce(填选项字母)
(5)实验结束后发现装置A中硬质玻璃管右端有水珠,你认为利用实验中所提供的数据还能否得到准确的w(NaHCO3),若能,则w(NaHCO3)的计算式为:$\frac{42({m}_{5}-{m}_{3})}{11{m}_{1}}$×100%(若不能,此问不作答.)
 小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•l0H2O,为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如图装置进行实验.
小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•l0H2O,为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如图装置进行实验.实验过程:
I.按图组装仪器,检查装置的气密性;
II.将m1 g试样放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量为m2g、装置C的质量为m3 g;
Ⅲ,关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;Ⅳ.称得装置B的质量为m4g、装置C的质量为m5g.
请回答以下问题(装置中原有空气对实验的影响忽略不计):
(1)装置A中发生反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;Na2CO3•10H2O$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+10H2O.
(2)装置B的作用为吸收反应生成的水蒸气.装置C的作用为吸收反应生成的二氧化碳.
(3)实验过程中通入N2的目的为使装置中的二氧化碳和水蒸气全部排出被装置BC全部吸收.
(4)用下列各项所提供的数据能计算出NaHCO3的质量分数w(NaHCO3)的是bce(填选项字母)
| 序号 | a | b | c | d | e |
| 数据 | m1、m2、m3 | m2、m3、m4、m5 | m1、m2、m4 | m1、m4、m5 | m1、m3、m5 |
4.下列化学反应属于吸热反应的是( )
| A. | 盐酸与烧碱溶液的反应 | B. | Al与稀盐酸的反应 | ||
| C. | C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO | D. | 葡萄糖在人体内氧化分解 |
1.一定条件下的反应:PCl5(g)?PCl3(g)+Cl2(g)△H>0.达到平衡后,下列情况使PCl5分解率降低的是( )
| A. | 温度不变,增大容器体积 | B. | 体积不变,对体系加热 | ||
| C. | 温度和体积不变,充入氩气 | D. | 温度和体积不变,充入氯气 |
8.含硅物质在生产生活中应用广泛,下列含硅物质的用途中涉及化学性质的是( )
| A. | 单晶硅制芯片 | B. | SiO2制光导纤维 | ||
| C. | 金刚砂(碳化硅)作砂轮的磨料 | D. | 水玻璃作黏合剂 |
5.25℃时,几种弱酸的电离常数如下:
25℃时,下列说法正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7K2=7.l×10-15 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | CH3COONa溶液中,其水解平衡常数K=Kw×10-5 | |
| C. | NaHS 和 Na2S混合溶液中,存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) | |
| D. | 某浓度NaCN的水溶液pH=d,则其中c(OH-)=10-d mol•L-1 |
3.中学化学二氧化锰常作催化剂和氧化剂,在下列四种溶液中,分别加入少量固体二氧化锰,能产生气体的是( )
| A. | 3%H2O2溶液 | B. | 0.1mol•L-1 NaOH 溶液 | ||
| C. | 0.1 mol•L-1 KClO3 溶液 | D. | 0.1 mol•L-1 盐酸 |

 ;
;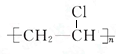 ,其反应类型为加聚反应.
,其反应类型为加聚反应.