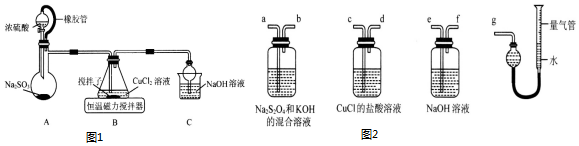
题目内容
8.含硅物质在生产生活中应用广泛,下列含硅物质的用途中涉及化学性质的是( )| A. | 单晶硅制芯片 | B. | SiO2制光导纤维 | ||
| C. | 金刚砂(碳化硅)作砂轮的磨料 | D. | 水玻璃作黏合剂 |
分析 根据已有的知识进行分析,化学性质是指需要发生化学变化表现出来的性质,物理性质是指不需要发生化学变化表现出来的性质.
解答 解:A、单晶硅制芯片是半导体,利用的是物理性质,故A不选;
B、SiO2制光导纤维是利用物理性质,故B不选;
C、金刚石用于切割玻璃是利用了金刚石的硬度大的性质,是金刚石的物理性质,故C不选;
D、水玻璃作黏合剂,是硅酸钠水解呈碱性,利用的化学性质,故D选;
故选D.
点评 本题考查了硅和硅的化合物的性质,完成此题,可以依据已有的知识进行,学生要清楚水解是化学性质.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
18.用如图装置可以进行实验并达达到实验目的是( )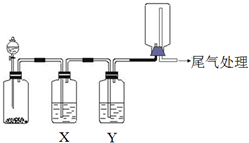

| 选项 | 实验目的 | X中试剂 | Y中 试剂 |
| A | 粗锌与稀盐酸制取 收集干燥的氢气 | 饱和食盐水 | 浓硫酸 |
| B | Na2SO3固体与较浓盐酸 反应制取收集干燥SO2 | 饱和Na2SO3溶液 | 浓硫酸 |
| C | 铜与稀硝酸制取并收集 纯净干燥的NO | 水 | 浓硫酸 |
| D | CaCO3和稀盐酸制取收集 纯净干燥的CO2 | 饱和NaHCO3溶液 | 浓硫酸 |
| A. | A | B. | B | C. | C | D. | D |
3.下列离子方程式属于水解的是( )
| A. | HCO3-+H2O?H3O++CO32- | B. | ClO-+H3O+?HClO+H2O | ||
| C. | HS-+H2O?H2S+OH- | D. | NH4++OH-?NH3•H2O |
13.表是元素周期表的一部分.X、Y、Z、W均为短周期元素,X、W的质子数之和为23.下列说法正确的是( )
| X | Y | ||
| Z | W |
| A. | W元素的非金属性比Z元素的非金属性弱 | |
| B. | Z和X能以共价键结合形成一种无机非金属材料 | |
| C. | Y元素的最高价氧化物的水化物是含氧酸中酸性最强的 | |
| D. | X的气态氢化物是同主族元素气态氢化物中最稳定的,原因是其分子间有氢键 |
17.具有还原性的弱酸H3PO2可用电渗析法制备.“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过).下列说法不正确的是( )


| A. | 阳极的电极反应式:4OH--4e-═O2↑+2H2O | |
| B. | 若将阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,同样可制得纯净物的H3PO2 | |
| C. | H3PO2分子中P元素的化合价为+1价 | |
| D. | 阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2 |
15. 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为CH3COOH>H2CO3>HClO.
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为
CO32->ClO->HCO3->CH3COO-.
(3)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:ClO-+H2O+CO2=HClO+HCO3-.
(4)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,填写下列表达式中的数据变化情况(填“变大”、“变小”或“不变”)
①$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$变大; ②$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变.
(5)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数,理由是当完全电离时应该是PH=4,现在PH值HX>CH3COOH,说明原来HX电离更多,故HX的电离平衡常数>醋酸的电离平衡常数.
 25℃时,部分物质的电离平衡常数如表所示:
25℃时,部分物质的电离平衡常数如表所示:| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为CH3COOH>H2CO3>HClO.
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为
CO32->ClO->HCO3->CH3COO-.
(3)将少量CO2气体通入NaClO溶液中,写出反应的离子方程式:ClO-+H2O+CO2=HClO+HCO3-.
(4)常温下0.1mol•L-1的CH3COOH溶液在加水稀释过程中,填写下列表达式中的数据变化情况(填“变大”、“变小”或“不变”)
①$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$变大; ②$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变.
(5)体积为10mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数大于(填“大于”、“等于”或“小于”)醋酸的电离平衡常数,理由是当完全电离时应该是PH=4,现在PH值HX>CH3COOH,说明原来HX电离更多,故HX的电离平衡常数>醋酸的电离平衡常数.
 某研究性学习小组设计了一组实验探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用图装置完成了O元素的非金属性比S强的实验研究.回答下列问题:
某研究性学习小组设计了一组实验探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用图装置完成了O元素的非金属性比S强的实验研究.回答下列问题: