题目内容
5.25℃时,几种弱酸的电离常数如下:| 弱酸化学式 | CH3COOH | HCN | H2S |
| 电离常数(25℃) | 1.8×10-5 | 4.9×10-10 | K1=1.3×10-7K2=7.l×10-15 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(CH3COONa)>pH(Na2S)>pH(NaCN) | |
| B. | CH3COONa溶液中,其水解平衡常数K=Kw×10-5 | |
| C. | NaHS 和 Na2S混合溶液中,存在c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-) | |
| D. | 某浓度NaCN的水溶液pH=d,则其中c(OH-)=10-d mol•L-1 |
分析 A.电离平衡常数越大,酸性越强,电离程度越大,溶液的pH越高;
B.CH3COONa溶液中醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-;
C.NaHS 和 Na2S混合溶液中存在电荷守恒;
D.某浓度NaCN的水溶液pH=d,CN-+H2O?HCN+OH-,则其中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-d}}$;
解答 解:A.由表格中的数据可知,醋酸电离平衡常数最大,酸性最强,则酸性越强,盐的水解越弱,所以等物质的量浓度溶液的pH关系为pH(Na2S)>pH(NaCN)>pH(CH3COONa),故A错误;
B.CH3COONa溶液中醋酸根离子水解溶液显碱性,CH3COO-+H2O?CH3COOH+OH-,K=$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$=$\frac{c(C{H}_{3}COOH)c(O{H}^{-})}{c(C{H}_{3}CO{O}^{-})}$×$\frac{c({H}^{+})}{c({H}^{+})}$=$\frac{Kw}{Ka}$,
C.NaHS 和 Na2S混合溶液中存在电荷守恒,c(Na+)+c(H+)=c(OH-)+c(HS-)+2c(S2-),故C正确;
D.某浓度NaCN的水溶液pH=d,CN-+H2O?HCN+OH-,则其中c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-d}}$=10-14+d,故D错误;
故选C.
点评 本题考查了弱电解质电离平衡、盐类水解平衡、电解质溶液中电荷守恒、溶液酸碱性的分析判断,掌握基础是解题关键,题目难度中等.

练习册系列答案
相关题目
15.NA表示阿伏伽德罗常数,下列叙述正确的是( )
| A. | 250 mL 1 mol•L-1FeCl3溶液中,阴、阳离子总数为NA | |
| B. | 室温下,1L pH=13的NaOH溶液中,由水电离的OH-数目为0.1NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 0.1mol HCN分子中含有的π键数目为0.2NA |
13.表是元素周期表的一部分.X、Y、Z、W均为短周期元素,X、W的质子数之和为23.下列说法正确的是( )
| X | Y | ||
| Z | W |
| A. | W元素的非金属性比Z元素的非金属性弱 | |
| B. | Z和X能以共价键结合形成一种无机非金属材料 | |
| C. | Y元素的最高价氧化物的水化物是含氧酸中酸性最强的 | |
| D. | X的气态氢化物是同主族元素气态氢化物中最稳定的,原因是其分子间有氢键 |
10.(1)标准状况下,1m3的可燃冰可转化为160L甲烷和0.8m3的水.则可燃冰中n(CH4):n(H2O)=$\frac{160}{22.4}$:$\frac{8×1{0}^{5}}{18}$(列出计算式即可).
(2)羰基硫(COS)多产生于煤化工合成气中,能引起催化剂中毒,可通过水解反应:COS(g)+H2O (g)?H2S(g)+CO2(g)△H除去.相关的化学键键能数据如表;
则△H为)=-35kJ/mol.
(3)近期太阳能利用又有新进展.利用太阳能由CO2制取C的原理如图1所示,若重整系统发生的反应中$\frac{n(FeO)}{n(C{O}_{2})}$=4,则重整系统中发生反应的化学方程式4FeO+CO2$\frac{\underline{\;700K\;}}{\;}$C+2Fe2O3.
(4)NaHS可用于污水处理的沉淀剂.已知:25℃时,H2S的电离常数Ka1=1.0×10-7,Ka2=7.0×10-15,反应Hg2+(aq)+HS-(aq)?HgS(s)+H+(aq)的平衡常数K=1.75×1038,则Ksp(HgS)=4.0×10-53.

(5)已知CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42kJ•mol-1,在进气比[n(CO):n(H2O)]不同时,测得相应的CO的平衡转化率如图2,图中各点对应的反应温度可能相同,也可能不同.图中D、E两点对应的反应温度分别为TD和TE.判断:2TD<TE(填“<”、“=”或“>”).
②与图2中E点对应的反应温度相同的为AG(填字母,多填倒扣分).
(2)羰基硫(COS)多产生于煤化工合成气中,能引起催化剂中毒,可通过水解反应:COS(g)+H2O (g)?H2S(g)+CO2(g)△H除去.相关的化学键键能数据如表;
| 化学键 | C=O(CO2) | C=O(COS) | C=S(COS) | H-S | H-O |
| E/kJ•mol-1 | 803 | 742 | 577 | 339 | 465 |
(3)近期太阳能利用又有新进展.利用太阳能由CO2制取C的原理如图1所示,若重整系统发生的反应中$\frac{n(FeO)}{n(C{O}_{2})}$=4,则重整系统中发生反应的化学方程式4FeO+CO2$\frac{\underline{\;700K\;}}{\;}$C+2Fe2O3.
(4)NaHS可用于污水处理的沉淀剂.已知:25℃时,H2S的电离常数Ka1=1.0×10-7,Ka2=7.0×10-15,反应Hg2+(aq)+HS-(aq)?HgS(s)+H+(aq)的平衡常数K=1.75×1038,则Ksp(HgS)=4.0×10-53.

(5)已知CO(g)+H2O(g)?CO2(g)+H2(g)△H=-42kJ•mol-1,在进气比[n(CO):n(H2O)]不同时,测得相应的CO的平衡转化率如图2,图中各点对应的反应温度可能相同,也可能不同.图中D、E两点对应的反应温度分别为TD和TE.判断:2TD<TE(填“<”、“=”或“>”).
②与图2中E点对应的反应温度相同的为AG(填字母,多填倒扣分).
17.具有还原性的弱酸H3PO2可用电渗析法制备.“四室电渗析法”工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过).下列说法不正确的是( )


| A. | 阳极的电极反应式:4OH--4e-═O2↑+2H2O | |
| B. | 若将阳极室的稀硫酸用H3PO2稀溶液代替,并撤去阳极室与产品室之间的阳膜,从而合并了阳极室与产品室,同样可制得纯净物的H3PO2 | |
| C. | H3PO2分子中P元素的化合价为+1价 | |
| D. | 阳极室的H+穿过阳膜扩散至产品室,原料室的H2PO2-穿过阴膜扩散至产品室,二者反应生成H3PO2 |
14.pH是溶液中c(H+)的负对数,若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,某浓度的草酸(H2C2O4)水溶液中pC(H2C2O4),pC(HC2O4-)、pC(C2O42-)随着溶液pH的变化曲线如图所示:下列说法不正确的是( )

| A. | 曲线I代表HC2O4-的浓度随着pH增大先变小后变大 | |
| B. | 草酸的电离常数 Kal=l×10-1.3; Ka2=l×10-4.3 | |
| C. | pH=4时,c(HC2O4-)>c(C2O42-)>c(H2C2O4) | |
| D. | $\frac{{c({C_2}{O_4}^{2-})•c({H_2}{C_2}{O_4})}}{{{c^2}(H{C_2}{O_4}^-)}}={10^{-3}}$ |
12. 常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
 常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )
常温下,取pH=2的两种二元酸H2A与H2B各1mL,分别加水稀释,测得pH变化与加水稀释倍数有如图所示变化,则下列有关叙述正确的是( )| A. | H2A为二元弱酸,稀释前c(H2A)=0.005mol/L | |
| B. | NaHA水溶液中:c(Na+)+c(H+)=2c(A2-)+c(OH-) | |
| C. | 含等物质的量的NaHA、NaHB的混合溶液中:c(Na+)=c(A2-)+c(B2-)+c(HB-)+c(H2B) | |
| D. | pH=10的NaHB溶液中,离子浓度大小为:c(Na+)>c(HB-)>c(OH-)>c(B2-)>c(H2B) |
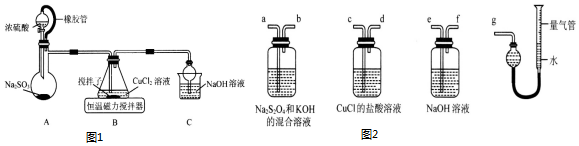
 某研究性学习小组设计了一组实验探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用图装置完成了O元素的非金属性比S强的实验研究.回答下列问题:
某研究性学习小组设计了一组实验探究元素周期律.甲同学根据元素非金属性与对应最高价含氧酸之间的关系,设计了如图装置一次性完成N、C、Si的非金属性强弱比较的实验研究;乙同学根据置换反应的规律,利用图装置完成了O元素的非金属性比S强的实验研究.回答下列问题: