题目内容
12.下列叙述错误的是( )| A. | 用水可区分苯和溴苯 | |
| B. | 用高锰酸钾酸性溶液可区分己烷和3-己烯 | |
| C. | 用新制的银氨溶液可区分甲酸甲酯和乙醛 | |
| D. | 用金属钠可区分乙醇和乙醚 |
分析 A.苯、溴苯均不溶于水,苯的密度比水小,溴苯密度比水大;
B.3-己烯能被高锰酸钾氧化,己烷不能;
C.甲酸甲酯和乙醛均含-CHO;
D.乙醇与Na反应生成氢气,而乙醚与Na不反应.
解答 解:A.苯、溴苯均不溶于水,苯的密度比水小,溴苯密度比水大,则与水分层现象不同,水可鉴别,故A正确;
B.3-己烯能被高锰酸钾氧化,己烷不能,则高锰酸钾溶液能区分,故B正确;
C.甲酸甲酯和乙醛均含-CHO,均与银氨溶液发生银镜反应,现象相同不能鉴别,故C错误;
D.乙醇与Na反应生成氢气,而乙醚与Na不反应,现象不同,可利用Na区分,故D正确;
故选C.
点评 本题考查物质的鉴别和检验,为高频考点,把握物质的性质、发生的反应和现象为解答的关键,侧重分析与应用能力的考查,注意有机物的性质应用,题目难度不大.

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
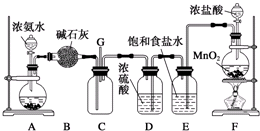
16.下列选用的仪器和药品能达到实验目的是( )
| A | B | C | D |
 |  | 饱和NaHSO3溶液 |  |
| 制乙炔的发生装置 | 蒸馏时的接收装置 | 除去SO2中的少量HCl | 准确量取一定体积K2Cr2O7标准溶液 |
| A. | A | B. | B | C. | C | D. | D |
3.下列生活中的化学的说法,不正确的是( )
| A. | 用热的纯碱可除去炊具上的油污 | |
| B. | 垃圾是放错地方的资源,应分类回收利用 | |
| C. | 石油分馏可获得乙烯、丙烯和丁二烯 | |
| D. | 红葡萄酒储藏时间长后变香是因为乙醇发生了酯化反应 |
20.下列叙述正确的是( )
| A. | 同周期元素中,ⅦA族元素的原子半径最大 | |
| B. | 原子核外各电子层容纳的电子数为2n2个 | |
| C. | 核外电子的分层排布就是核外电子的分层运动 | |
| D. | ⅥA族元素的原子,其半径越大,越容易得电子 |
7.表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
(1)在③~⑦元素中,原子半径最大的是Na,其离子的原子结构示意图为
(2)写出⑤和⑨最高价氧化物对应水化物间发生反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(3)按要求写出下列两种物质的电子式:①的单质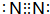 ;⑨的过氧化物
;⑨的过氧化物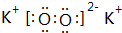 ;
;
(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):Cl2+2NaBr=2NaCl+Br2.
(5)请用电子式表示④和⑩组成的化合物的形成过程 .
.
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |

(2)写出⑤和⑨最高价氧化物对应水化物间发生反应的离子方程式:Al(OH)3+OH-=AlO2-+2H2O.
(3)按要求写出下列两种物质的电子式:①的单质
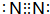 ;⑨的过氧化物
;⑨的过氧化物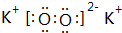 ;
;(4)在⑦与⑩的单质中,化学性质较活泼的是Cl2,可用什么化学反应说明该事实(写出反应的化学方程式):Cl2+2NaBr=2NaCl+Br2.
(5)请用电子式表示④和⑩组成的化合物的形成过程
 .
.
17.醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:

可能用到的有关数据如下:
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置a的名称是蒸馏烧瓶.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并捡漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是吸收水.
(5)在环己烯粗产物蒸馏过程中,可能用到的仪器有ABE(填正确答案标号).
A圆底烧瓶 B温度计 C漏斗 D玻璃棒 E接收器
(6)本实验中最容易产生的副产物的结构简式为 .
.

可能用到的有关数据如下:
| 相对分子质量 | 密度(g/cm3) | 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置a的名称是蒸馏烧瓶.
(2)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是B(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)分液漏斗在使用前须清洗干净并捡漏;在本实验分离过程中,产物应该从分液漏斗的上口倒出(填“上口倒出”或“下口放出”).
(4)分离提纯过程中加入无水氯化钙的目的是吸收水.
(5)在环己烯粗产物蒸馏过程中,可能用到的仪器有ABE(填正确答案标号).
A圆底烧瓶 B温度计 C漏斗 D玻璃棒 E接收器
(6)本实验中最容易产生的副产物的结构简式为
 .
.
2.NA表示阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 6.4gCu在足量的硫蒸气中燃烧,转移的电子数为0.1NA | |
| B. | 标准状况下,11.2LSO2和SO3的混合物中硫原子数为0.5NA | |
| C. | 1L0.1mol•L-1的NH4Cl溶液中NH4+数目为0.1NA | |
| D. | 通常情况下,3.4gNH3中共用电子对数为0.8NA |