题目内容
3.下列生活中的化学的说法,不正确的是( )| A. | 用热的纯碱可除去炊具上的油污 | |
| B. | 垃圾是放错地方的资源,应分类回收利用 | |
| C. | 石油分馏可获得乙烯、丙烯和丁二烯 | |
| D. | 红葡萄酒储藏时间长后变香是因为乙醇发生了酯化反应 |
分析 A.热的纯碱可促进油污的水解;
B.垃圾可回收再利用;
C.石油分馏的产品主要为饱和烃类物质;
D.变香与乙酸乙酯生成有关.
解答 解:A.热的纯碱可促进油污的水解,则用热的纯碱可除去炊具上的油污,故A正确;
B.垃圾可回收再利用,垃圾资源化,则垃圾是放错地方的资源,应分类回收利用,故B正确;
C.石油分馏的产品主要为饱和烃类物质,而裂解得到烯烃类物质,故C错误;
D.变香与乙酸乙酯生成有关,则红葡萄酒储藏时间长后变香是因为乙醇发生了酯化反应,故D正确;
故选C.
点评 本题考查物质的性质及应用,为高频考点,把握物质的性质、发生的反应和性质与用途的关系为解答的关键,侧重分析与应用能力的考查,注意化学与生活的联系,题目难度不大.

练习册系列答案
相关题目
19.下列物质中属于离子化合物的是( )
| A. | AlCl3 | B. | KOH | C. | HCl | D. | H2O |
5.下列说法正确的是( )
| A. | 氢氧燃料电池工作时,H2在负极上失去电子 | |
| B. | 0.1mol•L-1Na2CO3溶液加热后,溶液的pH减小 | |
| C. | 常温常压下,22.4LCl2中含有的分子数为6.02×1023个 | |
| D. | 室温下,稀释0.1mol•L-1CH3COOH溶液,溶液的导电能力增强 |
8.设NA为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 常温下,1L0.1mol/LNH4NO3溶液中的氮原子数为0.2NA | |
| B. | 常温下,向含1molH2SO4的浓硫酸加入足量的铁粉,转移的电子数为2NA | |
| C. | 标准状况下,2.24L己烷分子中含有1.9NA对共用电子 | |
| D. | 将1mol明矾晶体完全溶于水制成胶体,其中所含胶体微粒数目为NA |
15.下列表达式中正确的是( )
| A. | 氯化氢分子的电子式: | B. | S2-的结构示意图: | ||
| C. | 四氯化碳的电子式: | D. | N2分子的结构式:N=N |
12.下列叙述错误的是( )
| A. | 用水可区分苯和溴苯 | |
| B. | 用高锰酸钾酸性溶液可区分己烷和3-己烯 | |
| C. | 用新制的银氨溶液可区分甲酸甲酯和乙醛 | |
| D. | 用金属钠可区分乙醇和乙醚 |
13.某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验.
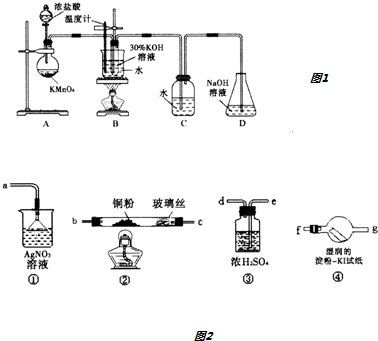
【实验一】制取氯酸钾和氯水.
利用如图1所示实验装置和药品进行实验.
(1)装置A中玻璃仪器为圆底烧瓶和分液漏斗,若对调B和C装置的位置,可能(填“可能”或“不可能”)提高B中氯酸钾的产率.
【实验二】检验上述制备Cl2中混有的HCl.
选用图1装置A和图2所给装置以及药品进行实验.
(2)实验仪器接口连接顺序为:装置A→e、d→b、c→f、g→a.
能证明HCl存在的现象是④中淀粉-KI试纸不变蓝色,装置①中产生白色沉淀.
【实验三】氯酸钾与碘化钾反应的研究.
在不同条件下KClO3可将KI氧化为I2或KIO3.该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
(3)系列a实验的实验目的是研究反应体系中硫酸浓度对反应产物的影响,设计1号试管实验的作用是硫酸浓度为0的对比实验.
【实验四】比较HClO与HCO3-电离常数的大小和测定饱和氯水中氯元素的总量.
查阅资料知:
i.实验室难以获得纯HClO溶液;
ii.次氯酸会破坏酸碱指示剂;
iii.次氯酸或氯气可被SO2、H2O2、和FeCl2等物质还原成Cl-.
(4)设计实验证明(实验方案不必描述操作过程的细节);
①相同条件下,HClO的电离常数大于HCO3-:配制相同物质的量浓度的碳酸钠和次氯酸钠溶液,用pH计分别测定两种溶液的pH值.
②确定饱和氯水中氯元素的总量:量取一定量的试样,加入足量的双氧水溶液,充分反应后,加热除去过量的双氧水,冷却,再加入足量的硝酸银溶液,过滤,洗净烘干后称量沉淀质量,计算可得.

【实验一】制取氯酸钾和氯水.
利用如图1所示实验装置和药品进行实验.
(1)装置A中玻璃仪器为圆底烧瓶和分液漏斗,若对调B和C装置的位置,可能(填“可能”或“不可能”)提高B中氯酸钾的产率.
【实验二】检验上述制备Cl2中混有的HCl.
选用图1装置A和图2所给装置以及药品进行实验.
(2)实验仪器接口连接顺序为:装置A→e、d→b、c→f、g→a.
能证明HCl存在的现象是④中淀粉-KI试纸不变蓝色,装置①中产生白色沉淀.
【实验三】氯酸钾与碘化钾反应的研究.
在不同条件下KClO3可将KI氧化为I2或KIO3.该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
| 试管编号 | 1 | 2 | 3 | 4 |
| 0.20mol•L-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
| KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
| 6.0mol•L-1H2SO4/ml | 0 | 3.0 | 6.0 | 9.0 |
| 蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
【实验四】比较HClO与HCO3-电离常数的大小和测定饱和氯水中氯元素的总量.
查阅资料知:
i.实验室难以获得纯HClO溶液;
ii.次氯酸会破坏酸碱指示剂;
iii.次氯酸或氯气可被SO2、H2O2、和FeCl2等物质还原成Cl-.
(4)设计实验证明(实验方案不必描述操作过程的细节);
①相同条件下,HClO的电离常数大于HCO3-:配制相同物质的量浓度的碳酸钠和次氯酸钠溶液,用pH计分别测定两种溶液的pH值.
②确定饱和氯水中氯元素的总量:量取一定量的试样,加入足量的双氧水溶液,充分反应后,加热除去过量的双氧水,冷却,再加入足量的硝酸银溶液,过滤,洗净烘干后称量沉淀质量,计算可得.