题目内容
7.亚硝酸钠广泛应用于工业和建筑业,也允许作为肉制品发色剂或防腐剂限量使用.亚硝酸(HNO2)很不稳定,室温下立即分解.已知:Ki(HNO2)=5×10-4;Ki(CH3COOH)=1.75×10-5;Kii(H2SO3)=1.6×10-2
完成下列填空:
(1)在酸性KMnO4溶液中滴入NaNO2溶液,溶液褪色.写出该反应的离子方程式5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O.
(2)往冷NaNO2溶液中加入或通入某种物质可得到HNO2溶液.该物质是a(选填序号).
a.稀硫酸b.二氧化碳 c.二氧化硫 d.醋酸
(3)某厂用HNO3和SO2为原料,得到硫酸同时将所得NO与NO2混合气体通入NaOH溶液生产NaNO2.
①要得到最高产率的NaNO2,则HNO3和SO2反应的化学方程式为2SO2+2HNO3+H2O=NO+NO2+2H2SO4.
②生产中,硝酸浓度过高,NaNO2产率偏低(选填“偏低”、“偏高”、“不变”),原因是硝酸浓度过大,主要还原生成NO2,导致亚硝酸钠产率降低.硝酸浓度过低,NaNO2产率偏低(选填“偏低”、“偏高”、“不变”),原因是若硝酸浓度过低,分解塔中出来的主要是NO,亚硝酸钠产率也低.
(4)要使等浓度等体积的NaNO2溶液与CH3COONa溶液pH相等,可采取的措施是bc.(选填序号)
a.向NaNO2溶液中加适量水
b.向NaNO2溶液中加适量NaOH
c.向CH3COONa溶液中加适量水
d.向CH3COONa溶液中加适量NaOH.
0.1mol/LNaNO2溶液与0.1mol/L CH3COONa溶液等体积混合,溶液中离子浓度大小关系为c(Na+)>c(NO2-)c(CH3COO-)>c(OH-)>c(H+).
分析 (1)酸性高锰酸钾具有强氧化性,将亚硝酸根离子氧化成硝酸根离子;
(2)根据强酸制取弱酸分析,亚硝酸具有强氧化性,能氧化具有还原性的物质,酸性强弱H2SO3>HNO2>CH3COOH>H2CO3;
(3)①得到硫酸同时将所得NO与NO2混合气体通入NaOH溶液生产NaNO2.则制备硫酸的反应是硝酸和二氧化硫反应生成硫酸和二氧化氮和一氧化氮;
②根据浓硝酸的还原产物是NO2,稀硝酸的还原产物是NO,据此分析;根据当硝酸过浓时,生成的二氧化氮过多来分析;
(4)要使等浓度等体积的NaNO2溶液与CH3COONa溶液pH相等,
a、溶液CH3COONa碱性大于NaNO2溶液,向溶液NaNO2中加适量水,稀释溶液,碱性减小;
b、向溶液NaNO2中加适量NaOH,增大溶液碱性;
c、向溶液CH3COONa中加适量水,稀释溶液碱性减弱;
d、溶液CH3COONa碱性大于NaNO2溶液,向溶液CH3COONa中加适量NaOH,溶液PH更大;
0.1mol/LNaNO2溶液与0.1mol/L CH3COONa溶液等体积混合,酸性HNO2>CH3COOH,CH3COONa溶液水解程度大.
解答 解:(1)酸性高锰酸钾具有强氧化性,能够将亚硝酸钠氧化成硝酸钠,反应的离子方程式为:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O,
故答案为:5NO2-+2MnO4-+6H+=5NO3-+2Mn2++3H2O;
(2)a.稀硫酸酸性强于HNO2,强酸制备弱酸,故a正确;
b.HNO2>H2CO3,浓NaNO2溶液中通入二氧化碳不能反应生成亚硝酸,故b错误;
c.如果通入二氧化硫,会被亚硝酸氧化为硫酸,故c错误;
d.酸性HNO2>CH3COOH,浓NaNO2溶液中加入醋酸不能生成亚硝酸,故d错误,
故选a;
(3)将所得NO与NO2混合气体通入NaOH溶液生产NaNO2,要得到最高产率的NaNO2,反应为:NO+NO2+2NaOH=2NaNO2+H2O,
①得到硫酸同时将所得NO与NO2混合气体通入NaOH溶液生产NaNO2.则制备硫酸的反应是硝酸和二氧化硫反应生成硫酸和二氧化氮和一氧化氮,反应的化学方程式为:2SO2+2HNO3+H2O=NO+NO2+2H2SO4,
故答案为:2SO2+2HNO3+H2O=NO+NO2+2H2SO4;
②若硝酸浓度过低,分解塔中出来的主要是NO,亚硝酸钠产率也低;当硝酸过浓时,生成的二氧化氮过多,还可能发生NO2与氢氧化钠的反应:2NO2+2NaOH═NaNO3+NaNO2+H2O,氮元素守恒可知,硝酸浓度过大,主要还原生成NO2,导致亚硝酸钠产率降低;若硝酸浓度过低,分解塔中出来的主要是NO,亚硝酸钠产率也低,
故答案为:偏低;硝酸浓度过大,主要还原生成NO2,导致亚硝酸钠产率降低;偏低;若硝酸浓度过低,分解塔中出来的主要是NO,亚硝酸钠产率也低;
(4)要使等浓度等体积的NaNO2溶液与CH3COONa溶液pH相等,
a、溶液CH3COONa碱性大于NaNO2溶液,向溶液NaNO2中加适量水,稀释溶液,碱性减小,不能调节溶液PH相同,故a错误;
b、向溶液NaNO2中加适量NaOH,增大碱性,可以调节溶液pH相同,故b正确;
c、向溶液CH3COONa中加适量水,稀释溶液碱性减弱,可以调节溶液pH,故c正确;
d、溶液CH3COONa碱性大于NaNO2溶液,向溶液CH3COONa中加适量NaOH,溶液PH更大,不能调节溶液PH相同,故d错误;
0.1mol/LNaNO2溶液与0.1mol/L CH3COONa溶液等体积混合,酸性HNO2>CH3COOH,CH3COONa溶液水解程度大,溶液中离子浓度大小关系为:c(Na+)>c(NO2-)c(CH3COO-)>c(OH-)>c(H+),
故答案为:bc;c(Na+)>c(NO2-)c(CH3COO-)>c(OH-)>c(H+).
点评 本题考查了亚硝酸钠的生产流程和过程中涉及到的氧化还原反应、盐类水解分析、酸的制备方法、电解质溶液中电离平衡、水解平衡的判断.掌握基础是解题关键,题目难度中等.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案| A. | c(CH3COO-)=c(Na+)时,参加反应的乙酸与氢氧化钠的物质的量之比为1:1 | |
| B. | c(CH3COO-)>c(Na+)>c(H+)>c(OH-)时,不一定是醋酸过量 | |
| C. | c(Na+)>c(CH3COO-)>c(OH-)>c(H+)时,一定是氢氧化钠过量 | |
| D. | c(CH3COO-)=c(Na+)时,该溶液一定呈中性 |
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
| A. | HNO3 | B. | HCl | C. | HBr | D. | HF |
| A. | 产生33.6L N2 | B. | 被还原的N原子为2mol | ||
| C. | 转移电子为4 mol | D. | 还原产物比氧化产物多0.5mol |
| A. | NaAlO2和KOH | B. | NaHCO3和Ca(OH)2 | C. | AlCl3和氨水 | D. | HCl和Na2CO3 |
 $→_{①}^{Cl_{2}光照}$
$→_{①}^{Cl_{2}光照}$ $→_{△②}^{NaOH醇溶液}$A$→_{③}^{Cl_{2}不见光}$B$\stackrel{④}{→}$
$→_{△②}^{NaOH醇溶液}$A$→_{③}^{Cl_{2}不见光}$B$\stackrel{④}{→}$ $\stackrel{⑤}{→}$
$\stackrel{⑤}{→}$ $\stackrel{⑥}{→}$C$→_{⑦}^{H_{2}}$
$\stackrel{⑥}{→}$C$→_{⑦}^{H_{2}}$
 ,C
,C .
.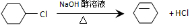 反应⑤
反应⑤ .
.