题目内容
15.在烧瓶中完成反应:2NaX+H2SO4(浓)$\stackrel{△}{→}$Na2SO4+2HX↑.则HX可以是( )| A. | HNO3 | B. | HCl | C. | HBr | D. | HF |
分析 A、硝酸是挥发性的酸,而硫酸难挥发;
B、盐酸是挥发性的酸,而硫酸难挥发;
C、氢溴酸具有还原性,而浓硫酸具有氧化性;
D、氢氟酸与烧瓶中的二氧化硅反应.
解答 解:A、硝酸是挥发性的酸,而硫酸难挥发,所以HX可以是硝酸,故A正确;
B、盐酸是挥发性的酸,而硫酸难挥发,可以用难挥发制易挥发,所以HX可以是盐酸,故B正确;
C、氢溴酸具有还原性,而浓硫酸具有氧化性,所以不能制氢溴酸,故C错误;
D、氢氟酸与烧瓶中的二氧化硅反应,所以不能制氢氟酸,故D错误;
故选AB.
点评 本题结合物质的性质,考查反应的可行性,综合性强,有一定的难度,考查学生分析和解决问题的能力.

练习册系列答案
相关题目
5.19世纪中叶,俄国化学家门捷列夫对化学这一学科的巨大贡献是( )
| A. | 提出了原子学说 | B. | 发现了元素周期律 | ||
| C. | 提出了分子学说 | D. | 制定了科学完整的元素周期表 |
6.化学与生产、生活、环境、社会密切相关,下列有关说法不正确的是( )
| A. | 航天服主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它属于新型无机非金属材料 | |
| B. | 工业生产玻璃、水泥、陶瓷,均需要用到石灰石为原料 | |
| C. | 用二氧化碳合成聚碳酸酯可降解塑料,可以实现“碳”的循环利用 | |
| D. | 固体煤经过处理变为气体燃料后,可以减少SO2和烟尘的排放,且燃烧效率提高,有利于“节能减排” |
3.下列关于有机化合物的结构、性质的叙述正确的是( )
| A. | 糖类、油脂、蛋白质的水解产物都是非电解质 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | 蔗糖、麦芽糖的分子式均为C12H22O11,二者互为同分异构体 | |
| D. | 乙醇、乙酸均能与NaOH反应,因为分子中均含有官能团“-OH” |
20.常温下pH=1的醋酸溶液和pH=13的NaOH溶液,下列叙述中正确的是( )
| A. | 混合前醋酸溶液中水的电离程度大 | |
| B. | 混合前c(CH3COOH)大于c(Na+) | |
| C. | 混合后若c(Na+)=c(CH3COO-),则混合前乙酸体积大 | |
| D. | 分别稀释10倍,两溶液的pH之和大于14 |
4.下列装置应用于实验室进行相关实验,能达到实验目的是( )
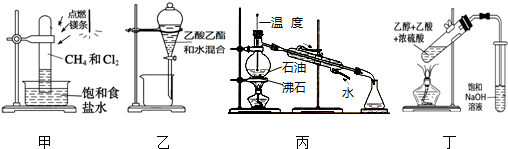

| A. | 用装置甲在强光照条件下制取一氯甲烷 | |
| B. | 用装置乙分离乙酸乙酯和水 | |
| C. | 用装置丙蒸馏石油并收集60~150℃馏分 | |
| D. | 用装置丁制取并收集乙酸乙酯 |
5.用NA表示阿伏加德罗常数,下列叙述中不正确的是 ( )
| A. | 3.2g由O2和O3组成的混合物中含有的原子数目为0.2NA | |
| B. | 高温下,0.2molFe与足量水蒸气反应,转移电子数目为0.6NA | |
| C. | 在过氧化钠与水的反应中,每消耗0.1mol过氧化钠,转移电子的数目为0.1NA | |
| D. | 在KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O反应中,若产生标准状况下6.72LCl2时,转移电子数目为0.5NA |
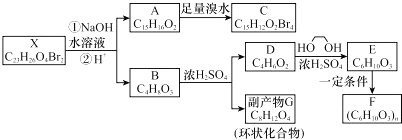
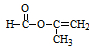 ;
; ;
; .
.