题目内容
19.已知有机化合物A只由C、H两种元素组成且能使溴水褪色,其产量可以用来衡量一个国家石油化工发展水平.A、B、C、D、E有如下关系:则下列推断不正确的是( )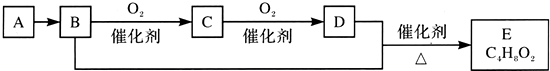
| A. | 鉴别A和甲烷可选择使用酸性高锰酸钾溶液 | |
| B. | D中含有的官能团为羧基,利用D物质可以清除水壶中的水垢 | |
| C. | 物质C的结构简式为CH3CHO,E的名称为乙酸乙酯 | |
| D. | B+D→E的化学方程式为CH3CH2OH+CH3COOH$?_{△}^{催化剂}$CH3COOC2H5 |
分析 化合物A只由碳、氢两种元素组成,能使溴水褪色,其产量用来衡量一个国家石油化工发展水平,则A是乙烯,B能被氧化生成C,C能被氧化生成D,B和D能反应生成E,则B是乙醇,C是乙醛,D是乙酸,乙醇和乙酸反应生成乙酸乙酯,即E为CH3COOC2H5.
解答 解:化合物A只由碳、氢两种元素组成,能使溴水褪色,其产量用来衡量一个国家石油化工发展水平,则A是乙烯,B能被氧化生成C,C能被氧化生成D,B和D能反应生成E,则B是乙醇,C是乙醛,D是乙酸,乙醇和乙酸反应生成乙酸乙酯,即E为CH3COOC2H5.
A.A为乙烯,含有碳碳双键,能使酸性高锰酸钾溶液褪色,甲烷不能,可用酸性高锰酸钾溶液鉴别二者,故A正确;
B.D为乙酸,醋酸的官能团为羧基,显酸性,可以与水垢的主要成分碳酸钙和氢氧化镁反应,故B正确;
C.物质C的结构简式为CH3CHO,E的名称为乙酸乙酯,故C正确;
D.酯化反应的产物还有水,反应方程式为:CH3CH2OH+CH3COOH$?_{△}^{催化剂}$CH3COOC2H5+H2O,故D错误.
故选:D.
点评 本题考查了有机物的推断,注意根据B能连续氧化,再结合B与D的产物推断,难度不大,D选项为易错点,学生容易忽略水.

练习册系列答案
相关题目
9.下列有关叙述正确的是( )
| A. | NH3•H2O的电离平衡常数随着温度升高而减小 | |
| B. | 在0.10 mol•L-1CH3COOH溶液中,加入少量CH3COONa晶体后,溶液的pH减小 | |
| C. | 强酸、强碱和大部分盐类都是强电解质,其他化合物都是弱电解质 | |
| D. | 相同温度下,醋酸溶液的导电能力可能比稀硫酸强 |
10.已知如下物质的溶度积常数:FeS:Ksp=6.3×10-18;CuS:Ksp=1.3×10-36;ZnS:Ksp=1.6×10-24.下列说法正确的是( )
| A. | 同温度下,CuS的溶解度大于ZnS的溶解度 | |
| B. | 将足量CuSO4溶解在0.1 mol•L-1的H2S溶液中,Cu2+能达到的最大浓度为1.3×10-35 mol•L-1 | |
| C. | 因为H2SO4是强酸,故CuSO4+H2S═CuS↓+H2SO4不能发生 | |
| D. | 除去工业废水中的Cu2+,可以选用FeS作沉淀剂 |
7.一段时间以来,各地巨能钙事件沸沸扬扬,原因在于部分巨能钙被检出含有双氧水,而双氧水有致癌性.因此卫生部已开始加紧调查巨能钙.下列有关说法错误的是( )
| A. | H2O2、Na2O2都属于过氧化物,都存在非极性的共价键 | |
| B. | 双氧水是绿色氧化剂,可作医疗消毒剂 | |
| C. | H2O2既有氧化性,又有还原性,与Cl2、KMnO4反应是表现H2O2的氧化性 | |
| D. | H2O2做漂白剂是利用其氧化性,漂白原理与HClO类似,与SO2不同 |
14.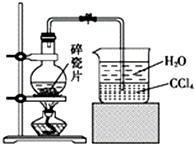 1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.
1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.
请回答下列问题:
(1)上述实验装置中长导管的作用是冷凝回流;导管末端插入CCl4中而不直接插入水中,除了能将挥发出的Br2、1-溴异戊烷等充分吸收外,另一个重要作用是防止倒吸.
(2)将1-溴异戊烷的粗产品置于分液漏斗中加水,振荡后静置,有机物将在下层(填“在上层”、“在下层”或“不分层”).
(3)在制备过程中,Br-可被氧化为Br2而引入杂质.欲除去Br2,可选用CE(填字母).
A.NaCl B.NaOH C.NaHSO3 D.KCl E.NaHCO3
(4)在制备1-溴异戊烷时,不能边反应边蒸出产物,其原因是1-溴丁烷与正丁醇的沸点差较小,若边反应边蒸出产物,会有较多的正丁醇挥发,降低原料的利用率.
(5)在实验室中还可用NaBr、浓H2SO4和异戊醇为原料制备1-溴异戊烷.已知反应物的用量如表:
若实验时1-溴异戊烷的产率为40%,则可制取1-溴异戊烷15.1g.
 1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.
1-溴异戊烷[(CH3)2CHCH2CH2Br]是有机合成的重要中间体,可用于生产染料、催化剂等,其沸点为121℃,易溶于CCl4,可由异戊醇与氢溴酸在硫酸催化作用下反应而得:(CH3)2CHCH2CH2OH+HBr$\stackrel{△}{→}$(CH3)2CHCH2CH2Br+H2O.已知异戊醇的沸点为132.5℃,微溶于水,易溶于CCl4.实验室制备1-溴异戊烷的装置如图所示.请回答下列问题:
(1)上述实验装置中长导管的作用是冷凝回流;导管末端插入CCl4中而不直接插入水中,除了能将挥发出的Br2、1-溴异戊烷等充分吸收外,另一个重要作用是防止倒吸.
(2)将1-溴异戊烷的粗产品置于分液漏斗中加水,振荡后静置,有机物将在下层(填“在上层”、“在下层”或“不分层”).
(3)在制备过程中,Br-可被氧化为Br2而引入杂质.欲除去Br2,可选用CE(填字母).
A.NaCl B.NaOH C.NaHSO3 D.KCl E.NaHCO3
(4)在制备1-溴异戊烷时,不能边反应边蒸出产物,其原因是1-溴丁烷与正丁醇的沸点差较小,若边反应边蒸出产物,会有较多的正丁醇挥发,降低原料的利用率.
(5)在实验室中还可用NaBr、浓H2SO4和异戊醇为原料制备1-溴异戊烷.已知反应物的用量如表:
| 反应物 | NaBr | 98.3% 浓H2SO4 | 异戊醇 | 水 |
| 用量 | 0.30mol | 35mL(过量) | 0.25mol | 30mL |
4.酯类物质广泛存在于草莓、香蕉、梨等水果中,某同学从成熟的香蕉中分离出一种酯,然后将该酯在酸性条件下进行水解实验,得到分子式为C2H4O2和C4H10O的两种物质.下列有关的分析判断正确的是( )
| A. | C4H10O的同分异构体有很多种,其中属于醇类的只有4种 | |
| B. | 水解得到的两种物质,C2H4O2可以与金属钠作用产生氢气,而C4H10O不可以 | |
| C. | 水解得到的物质C2H4O2和葡萄糖的最简式相同,所以二者的化学性质相似 | |
| D. | 该同学分离出的酯的化学式可表示为C6H12O2,它的同分异构体属于酯类的有10种 |
11.某固体物质和某溶液在一定条件下反应,产生气体(恢复至常温)的平均相对分子质量为45.8,则发生反应的物质不可能是( )
| A. | Zn和浓H2SO4 | B. | C和浓HNO3 | ||
| C. | Cu和浓HNO3 | D. | Na2O2和NH4Cl浓溶液 |
8.在密闭容器中进行如下反应:X2(g)+Y2(g)?2Z(g),已知X2、Y2、Z的起始浓度分别为0.1mol•Lˉ1、0.3mol•Lˉ1、0.2mol•Lˉ1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是(mol•Lˉ1)( )
| A. | Z为0.3 | B. | Y2为0.4 | C. | X2为0.2 | D. | Z为0.4 |
9.元素单质及其化合物有广泛用途,请根据周期表中第三周期元素相关知识回答下列问题:
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是b.
a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强
c.单质的熔点降低 d.氧化物对应的水合物碱性减弱,酸性增强
(2)原子最外层电子数与次外层电子数相同的元素名称为氩,氧化性最弱的简单阳离子是Na+.
(3)已知:
工业制镁时,电解MgCl2而不电解MgO的原因是MgO的熔点高,熔融时消耗更多能量,增加生产成本;制铝时,电解Al2O3而不电解AlCl3的原因是氯化铝是共价化合物,熔融态氯化铝难导电.
(4)晶体硅(熔点1410℃)是良好的半导体材料.由粗硅制纯硅过程如下:
Si(粗)$→_{460℃}^{Cl_{2}}$SiCl4$\stackrel{蒸馏}{→}$SiCl4(纯)$→_{1100℃}^{H_{2}}$Si(纯)
写出SiCl4的电子式: ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式2H2(g)+SiCl4(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1.
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式2H2(g)+SiCl4(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1.
(5)下列气体不能用浓硫酸干燥,可用P2O5干燥的是b.
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4.
(1)按原子序数递增的顺序(稀有气体除外),以下说法正确的是b.
a.原子半径和离子半径均减小 b.金属性减弱,非金属性增强
c.单质的熔点降低 d.氧化物对应的水合物碱性减弱,酸性增强
(2)原子最外层电子数与次外层电子数相同的元素名称为氩,氧化性最弱的简单阳离子是Na+.
(3)已知:
| 化合物 | MgO | Al2O3 | MgCl2 | AlCl3 |
| 类型 | 离子化合物 | 离子化合物 | 离子化合物 | 共价化合物 |
| 熔点/℃ | 2800 | 2050 | 714 | 191 |
(4)晶体硅(熔点1410℃)是良好的半导体材料.由粗硅制纯硅过程如下:
Si(粗)$→_{460℃}^{Cl_{2}}$SiCl4$\stackrel{蒸馏}{→}$SiCl4(纯)$→_{1100℃}^{H_{2}}$Si(纯)
写出SiCl4的电子式:
 ;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式2H2(g)+SiCl4(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1.
;在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式2H2(g)+SiCl4(g)$\frac{\underline{\;1100℃\;}}{\;}$Si(s)+4HCl(g)△H=+0.025akJ•mol-1.(5)下列气体不能用浓硫酸干燥,可用P2O5干燥的是b.
a.NH3 b.HI c.SO2 d.CO2
(6)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1.写出该反应的化学方程式:4KClO3$\frac{\underline{\;400℃\;}}{\;}$KCl+3KClO4.