题目内容
5.已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,关于A、B、C、D四种元素叙述正确的是( )| A. | 气态氢化物的稳定性:D>C | B. | 四种元素一定属于短周期元素 | ||
| C. | 单质的还原性:B>A | D. | 原子序数:b>a>c>d |
分析 由aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),则有A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d,结合元素周期律递变规律解答该题.
解答 解:已知aAn+、bB(n+1)+、cCn-、dD(n+1)-具有相同的电子层结构,则有:a-n=b-(n+1)=c+n=d+(n+1),则有A、B在周期表中C、D的下一周期,并且原子序数:b>a>c>d,则
A.C、D在同一周期,且原子序数C>D,非金属性:C>D,元素的非金属性越强,对应的氢化物越稳定,则气态氢化物的稳定性:C>D,故A错误;
B.A、B可能为第四周期元素,如K、Ca,故B错误;
C.A、B在周期表中同周期,原子序数:b>a,金属性:A>B,单质的还原性:A>B,故C错误;
D.由以上分析可知原子序数:b>a>c>d,故D正确;
故选D.
点评 本题考查原子结构与元素周期律,为高频考点,把握核外电子排布确定元素所在周期表中的位置以及把握元素周期律的递变规律是解答该题的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
16.以下元素均为短周期元素:
(1)B在周期表中的位置第二周期第VIA族,C离子的结构示意图 .
.
(2)D的最低价含氧酸的电子式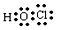 .
.
(3)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式2NH3-6e-+6OH-═N2+6H2O.(产物中无有毒有害物质)
(4)A在真空高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质.该反应的化学方程式:4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.
(5)仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比为1:1反应的离子方程式为CO32-+Cl2+H2O=HClO+Cl-+HCO3-.
| 元素代号 | 相关信息 |
| M | 非金属元素,其气态氢化物的水溶液呈碱性 |
| A | A的单质与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是内层电子数的三倍 |
| C | 在第三周期中,C的简单离子半径最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
 .
.(2)D的最低价含氧酸的电子式
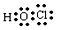 .
.(3)M的简单气态氢化物与B的单质形成燃料电池(KOH为电解液),写出其负极反应方程式2NH3-6e-+6OH-═N2+6H2O.(产物中无有毒有害物质)
(4)A在真空高压下能与由D、E组成的分子呈正四面体结构的化合物Y反应生成2种固体物质,其中一种是自然界中硬度最大的物质.该反应的化学方程式:4Na+CCl4$\frac{\underline{\;真空高压\;}}{\;}$4NaCl+C.
(5)仅由A、B、E组成的一种生活中的常用盐,其中A的质量分数为43%,其水溶液与D单质物质的量比为1:1反应的离子方程式为CO32-+Cl2+H2O=HClO+Cl-+HCO3-.
13.下列说法正确的是( )
| A. | 向氨水中不断通入CO2,随着CO2的增加,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断减小 | |
| B. | 在铜的精炼过程中,若转移1mol电子,则阳极一定溶解32gCu | |
| C. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)△H>0,△S<0 | |
| D. | 将如图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深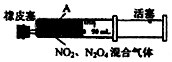 |
10.下列说法中错误的是( )
| A. | 卤化氢中,以HF沸点最高,是由于HF分子间存在氢键 | |
| B. | 邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低 | |
| C. | H2O的沸点比HF的沸点高,是由于水中氢键键能大 | |
| D. | 氨气极易溶于水与氨气分子和水分子形成氢键有关 |
17.下列各项表述正确的是( )
| A. | 丙烯的键线式: | B. | CH2F2的电子式: | ||
| C. | 醛基官能团符号:-COH | D. | -OH与 都表示羟基 都表示羟基 |
14.T1和T2温度下(T1>T2),BaSO4在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
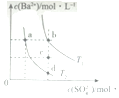

| A. | T1时,c点有沉淀生成 | |
| B. | T2时,蒸发溶剂可能由d点变到b点 | |
| C. | T2时,由a点开始加入BaCl2固体,Ksp增大 | |
| D. | BaSO4的溶解度随温度升高而增大 |
15.天然气经O2和H2O(g)重整制合成气,再由合成气制备甲醇的相关反应如下
①主反应;CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1
②副反应:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2
③主反应:CH4(g)+H2O(g)═CO+3H2(g)△H3=206.1KJ•mol-1
④主反应:CO(g)+2H2(g)═CH3OH(g)△H4=90.0KJ•mol-1
⑤副反应:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H5=49.0KJ•mol-1
下列说法正确的是( )
①主反应;CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1
②副反应:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2
③主反应:CH4(g)+H2O(g)═CO+3H2(g)△H3=206.1KJ•mol-1
④主反应:CO(g)+2H2(g)═CH3OH(g)△H4=90.0KJ•mol-1
⑤副反应:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H5=49.0KJ•mol-1
下列说法正确的是( )
| A. | △H1>△H2 | |
| B. | 设计反应①的主要目的是增大n(CO)/n(H2)的比值 | |
| C. | CO(g)+H2O(g)?CO2(g)+H2(g)的正反应为吸热反应 | |
| D. | △H2=4△H1=659.3 KJ•mol-1 |
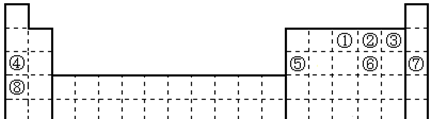
 ;写出②含有10个中子的核素的化学符号${\;}_{8}^{18}$O.
;写出②含有10个中子的核素的化学符号${\;}_{8}^{18}$O.