题目内容
3.反应N2+3H2?2NH3,在2L的密闭容器内进行到半分钟时,有0.6mol NH3生成,则下列反应速率不正确的是( )| A. | ${V}_{N{H}_{3}}$=0.6mol/L•min | B. | ${V}_{{N}_{2}}$=0.005mol/L•s | ||
| C. | ${V}_{{H}_{2}}$=0.9mol/L•min | D. | ${V}_{N{H}_{3}}$=0.02mol/L•s |
分析 根据v=$\frac{△c}{△t}$计算v(NH3),再根据速率之比等于化学计量数之比计算其它物质表示的速率.
解答 解:在2L的密闭容器中进行,半分钟内有0.6mol NH3生成,则v(NH3)=$\frac{\frac{0.6mol}{2L}}{30s}$=0.01 mol•L-1•s-1=0.6 mol•L-1•min-1,速率之比等于化学计量数之比,则:
v(N2)=$\frac{1}{2}$v(NH3)=0.005 mol•L-1•s-1,
v(H2)=$\frac{3}{2}$v(NH3)=0.9 mol•L-1•min-1,
故选D.
点评 本题考查化学反应速率有关计算,常用定义法与速率规律计算,注意对速率规律的理解.

练习册系列答案
 导学全程练创优训练系列答案
导学全程练创优训练系列答案
相关题目
13.下列说法正确的是( )
| A. | 向氨水中不断通入CO2,随着CO2的增加,$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$不断减小 | |
| B. | 在铜的精炼过程中,若转移1mol电子,则阳极一定溶解32gCu | |
| C. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)=4Fe(OH)3(s)△H>0,△S<0 | |
| D. | 将如图中的活塞快速推至A处固定,气体颜色先变深、再变浅,但比起始时深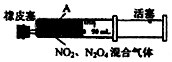 |
14.T1和T2温度下(T1>T2),BaSO4在水中的沉淀溶解平衡曲线如图所示,下列说法正确的是( )
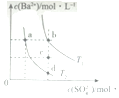

| A. | T1时,c点有沉淀生成 | |
| B. | T2时,蒸发溶剂可能由d点变到b点 | |
| C. | T2时,由a点开始加入BaCl2固体,Ksp增大 | |
| D. | BaSO4的溶解度随温度升高而增大 |
11.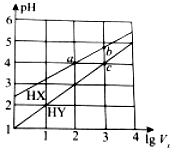 25℃时,将浓度均为0.1mol•L-1、体积均为1L的HX和HY两种酸溶液分别加水稀释至体积为V0,pH随lgV0的变化如图所示,则下列叙述不正确的是( )
25℃时,将浓度均为0.1mol•L-1、体积均为1L的HX和HY两种酸溶液分别加水稀释至体积为V0,pH随lgV0的变化如图所示,则下列叙述不正确的是( )
 25℃时,将浓度均为0.1mol•L-1、体积均为1L的HX和HY两种酸溶液分别加水稀释至体积为V0,pH随lgV0的变化如图所示,则下列叙述不正确的是( )
25℃时,将浓度均为0.1mol•L-1、体积均为1L的HX和HY两种酸溶液分别加水稀释至体积为V0,pH随lgV0的变化如图所示,则下列叙述不正确的是( )| A. | HX为弱酸,HY为强酸 | B. | 当lgV0=7时,HY的pH=8 | ||
| C. | 溶液中水的电离程度:a=c<b | D. | 当lgV0=2时,c(X-)<c(Y-) |
18.下列有关有机物的结构和性质的说法中,正确的是( )
| A. | 乙烯的结构简式为CH2CH2 | |
| B. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| C. | 苯和浓硝酸的反应与乙烯和Br2的反应属于同一类型的反应 | |
| D. | 可以用新制的氢氧化铜悬浊液检验尿液中是否含有葡萄糖 |
8.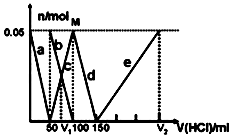 某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法正确的是( )
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法正确的是( )
(已知:H2CO3的电离平衡常数K1=4.3×10-7,K2=5.6×10-11;Al(OH)3的酸式电离平衡常数K=6.3×10-13)
 某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法正确的是( )
某Na2CO3、NaAlO2的混合溶液中逐滴加入1mol•L-1的盐酸,测得溶液中的CO32-、HCO3-、AlO2-、Al3+的物质的量与加入盐酸溶液的体积变化关系如图所示.则下列说法正确的是( )(已知:H2CO3的电离平衡常数K1=4.3×10-7,K2=5.6×10-11;Al(OH)3的酸式电离平衡常数K=6.3×10-13)
| A. | a曲线表示的离子方程式为:AlO2-+4H+=Al3++2H2O | |
| B. | M点时生成的CO2为0.05mol | |
| C. | 原混合溶液中的CO32-与AlO2-的物质的量之比为1:2 | |
| D. | V1:V2=1:4 |
15.天然气经O2和H2O(g)重整制合成气,再由合成气制备甲醇的相关反应如下
①主反应;CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1
②副反应:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2
③主反应:CH4(g)+H2O(g)═CO+3H2(g)△H3=206.1KJ•mol-1
④主反应:CO(g)+2H2(g)═CH3OH(g)△H4=90.0KJ•mol-1
⑤副反应:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H5=49.0KJ•mol-1
下列说法正确的是( )
①主反应;CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1
②副反应:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2
③主反应:CH4(g)+H2O(g)═CO+3H2(g)△H3=206.1KJ•mol-1
④主反应:CO(g)+2H2(g)═CH3OH(g)△H4=90.0KJ•mol-1
⑤副反应:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H5=49.0KJ•mol-1
下列说法正确的是( )
| A. | △H1>△H2 | |
| B. | 设计反应①的主要目的是增大n(CO)/n(H2)的比值 | |
| C. | CO(g)+H2O(g)?CO2(g)+H2(g)的正反应为吸热反应 | |
| D. | △H2=4△H1=659.3 KJ•mol-1 |
12.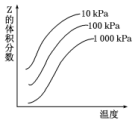 如图是温度和压强对反应X+Y?2Z影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )
如图是温度和压强对反应X+Y?2Z影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )
 如图是温度和压强对反应X+Y?2Z影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )
如图是温度和压强对反应X+Y?2Z影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )| A. | 恒容时,混合气体的密度可作为此反应是否达到化学平衡状态的判断依据 | |
| B. | X、Y、Z均为气态 | |
| C. | 上述反应的逆反应的△H>0 | |
| D. | 使用催化剂Z的产率提高 |
14.Ⅰ.已知:Na2S2O3+H2SO4═Na2SO4+SO2↑+S↓+H2O,某同学探究影响硫代硫酸钠与稀硫酸反应速率的因素时,设计了如表系列实验:
(1)该实验①、②可探究温度对反应速率的影响,因此V1=10.0,V2=10.0,V3=0.
(2)下列有关该实验的叙述正确的是A(填字母).
A.实验前,应先用黑墨水笔在白纸上画粗浅一致的“+”字,衬在锥形瓶底部,实验中记录反应开始到产生的浑浊将锥形瓶底部的“+”字刚好完全遮盖所需的时间
B.该实验所需的计量仪器有量筒、温度计
C.实验时,应先将量取的Na2S2O3和H2SO4溶液混合,然后置于相应温度的热水浴中反应,记录每组反应所需时间
(3)实验过程中为什么不用测量一定时间内放出SO2气体的量来表示该反应的化学反应速率的大小?SO2易溶于水,无法准确测量其体积.
Ⅱ.已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图2所示.
(4)25.0℃时,0~6min氨基甲酸铵水解反应的平均速率为0.05mol/(L•min).
(5)根据图中信息,如何说明该水解反应的速率随温度升高而增大:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
| 实验 序号 | 反应温 度/℃ | Na2S2O3溶液 | 稀硫酸 | H2O | ||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
(2)下列有关该实验的叙述正确的是A(填字母).
A.实验前,应先用黑墨水笔在白纸上画粗浅一致的“+”字,衬在锥形瓶底部,实验中记录反应开始到产生的浑浊将锥形瓶底部的“+”字刚好完全遮盖所需的时间
B.该实验所需的计量仪器有量筒、温度计
C.实验时,应先将量取的Na2S2O3和H2SO4溶液混合,然后置于相应温度的热水浴中反应,记录每组反应所需时间
(3)实验过程中为什么不用测量一定时间内放出SO2气体的量来表示该反应的化学反应速率的大小?SO2易溶于水,无法准确测量其体积.
Ⅱ.已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图2所示.
(4)25.0℃时,0~6min氨基甲酸铵水解反应的平均速率为0.05mol/(L•min).
(5)根据图中信息,如何说明该水解反应的速率随温度升高而增大:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.