题目内容
10.某铝土矿样品中含有Al2O3、Fe2O3和SiO2,进行一系列操作将它们分离:加入试剂、过滤、洗涤、灼烧等.依次加入的一组试剂是( )| A. | NaOH溶液、盐酸、氨气 | B. | 硫酸、NaOH溶液、盐酸 | ||
| C. | NaOH溶液、盐酸、CO2 | D. | 水、盐酸、NaOH溶液 |
分析 Al2O3、Fe2O3和SiO2均不溶于水,Al2O3、Fe2O3与盐酸反应,Al2O3、SiO2与NaOH反应,结合操作为加入试剂、过滤、洗涤、灼烧等来解答.
解答 解:含有Al2O3、Fe2O3和SiO2,先加NaOH溶液过滤分离出Fe2O3,
滤液中加足量盐酸分离出硅酸沉淀,灼烧得到SiO2,
滤液中通入氨气,过滤分离出氢氧化铝沉淀,灼烧得到Al2O3,
故选A.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异、发生的反应、混合物分离方法为解答的关键,侧重分析与应用能力的考查,注意元素化合物知识的应用,题目难度不大.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
11.下列关于纤维素的说法不正确的是( )
| A. | 纤维素是白色无臭无味的物质 | |
| B. | 纤维素是不显还原性的物质 | |
| C. | 纤维素不溶于水和一般的有机溶剂 | |
| D. | 纤维素可以发生水解反应,水解的最终产物是麦芽糖 |
1.某元素R的原子核外电子数等于核内中子数.取该元素单质2.8g与足量O2化合,可得6g氧化物RO2,则该元素在周期表中的位置是( )
| A. | 第三周期 | B. | 第二周期 | C. | ⅤA族 | D. | ⅤⅠA族 |
18.在通风橱中进行下列实验:
下列说法中不正确的是( )
| 步骤 | 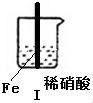 |  | |
| 现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面产生红棕色气泡 |
| A. | Ⅰ中气体由无色变红棕色的化学方程式为:2NO+O2═2NO2 | |
| B. | Ⅱ中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应 | |
| C. | 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化 | |
| D. | 对比Ⅰ、Ⅱ中现象,说明稀HNO3的氧化性强于浓HNO3 |
5. 高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( )
高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( )
 高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( )
高铁酸盐在能源环保领域有广泛用途.用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的装置如图所示.下列推断合理的是( )| A. | 铁是阳极,电极反应为 Fe-6e-+4H2O=FeO42-+8H+ | |
| B. | 电解时电子的流动方向为:负极→Ni电极→溶液→Fe电极→正极 | |
| C. | 若隔膜为阴离子交换膜,则电解结束后左侧溶液中含有FeO42- | |
| D. | 电解时阳极区pH 降低、阴极区 pH升高,撤去隔膜混合后,与原溶液比较 pH升高(假设电解前后体积变化忽略不计) |
15.下列化学用语正确的是( )
| A. | 羟基的电子式: | B. | 次氯酸的结构式:H-O-Cl | ||
| C. | 中子数为20的氯原子: | D. | 乙烯的分子式:CH2═CH2 |
2.“可燃冰”又称“天然气水合物”,它是在海底的高压、低温条件下形成的,外观像冰.1体积“可燃冰”可贮载100~200体积的天然气.下面关于“可燃冰”的叙述不正确的是( )
| A. | “可燃冰”有可能成为人类未来的重要能源 | |
| B. | “可燃冰”是一种比较洁净的能源 | |
| C. | “可燃冰”提供了水可能变成油的例证 | |
| D. | “可燃冰”的主要可燃成分是甲烷 |
19.下列关于 Na2CO3 和 NaHCO3 性质的比较中,正确的是( )
| A. | 等物质的量的固体与足量的盐酸反应放出CO2的质量:Na2CO3>NaHCO3 | |
| B. | 相同条件下,溶于水溶液的碱性:Na2CO3<NaHCO3 | |
| C. | 常温下,在水中的溶解度:Na2CO3>NaHCO3 | |
| D. | 相同条件下,与稀盐酸反应的快慢:Na2CO3>NaHCO3 |
 和
和  ④CH3CH2CH3和CH3CH3 ⑤氕和氘 ⑥CH3CH2CH2CH2CH3和CH3C(CH3)3
④CH3CH2CH3和CH3CH3 ⑤氕和氘 ⑥CH3CH2CH2CH2CH3和CH3C(CH3)3