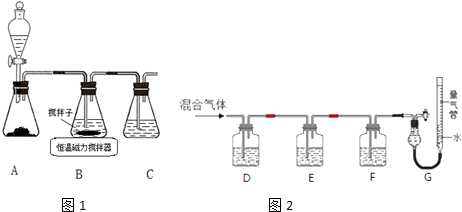
题目内容
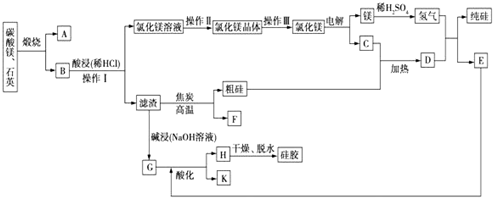
5.红矾钠(重铬酸钠:Na2Cr2O7•2H2O)是重要的基本化工原料,在印染工业、电镀工业和皮革工业中作辅助剂,在化学工业和制药工业中也可做氧化剂,应用领域十分广泛.实验室中红矾钠可用一种铬铁矿(主要成分:FeO•Cr2O3,还含有少量的Al2O3)通过以下图1过程来制取.回答下列问题:

(1)步骤Ⅰ中反应化学方程式为4FeO2•Cr2O3(s)+8Na2CO3(s)+7O2(g)═8Na2CrO4(s)+2Fe2O3(s)+8CO2(g).
①在实验室,步骤Ⅰ应在铁(填“陶瓷”或“铁”)坩埚中完成.
②在常温下该反应速率极慢,下列措施中能使反应速率增大的是AC(填字母).
A.将原料粉碎 B.增加纯碱的用量 C.升高温度
(2)步骤Ⅱ中NaOH的作用是Al2O3+2NaOH=2NaAlO2+H2O(用化学反应方程式表示).
(3)步骤Ⅳ中发生反应的离子方程式为2CrO42-+2H+=Cr2O72-+H2O;反应完成的标志是溶液由黄色变成橙色.
(4)利用下面的复分解反应,将红矾钠与KCl固体按1:2物质的量之比混合溶于水后经适当操作可得到K2Cr2O7晶体:Na2Cr2O7+2KCl═K2Cr2O7+2NaCl(已知:温度对氯化钠的溶解度影响很小,对重铬酸钾的溶解度影响较大)基本实验步骤为①溶解;②蒸发;③过滤;④冷却,结晶,再过滤得K2Cr2O7晶体.其中③应在高温(填“高温”或“低温”)条件下进行.
分析 铬铁矿(主要成分:FeO•Cr2O3,还含有少量的Al2O3)氧化后亚铁离子被氧化为铁离子,铬离子被氧化为+4价Na2CrO4,加入氢氧化钠溶液浸取,铁离子沉淀,氧化铝溶解生成偏铝酸钠,通过调节溶液PH,NaAlO2等杂质可以以沉淀的形式除去,水浸过滤后得到Na2CrO4溶液,加入硫酸酸化反应为:2Na2CrO4+H2SO4?Na2SO4+Na2Cr2O7+H2O,通过蒸发浓缩,冷却结晶,过滤洗涤得到晶体,以此解答该题.
解答 解:(1)①熔融状态下碳酸钠与二氧化硅等反应,可导致瓷坩埚炸裂,应在铁坩埚中进行,故答案为:铁;
②增大反应速率,可增大固体表面积、升高温度,由于为固体,则加入固体的量浓度不变,不影响速率,故答案为:AC;
(2)步骤II中加入NaOH溶液时氧化铝和氢氧化钠反应:2NaOH+Al2O3=2NaAlO2+H2O,除去氧化铝,NaAlO2等杂质可以以沉淀的形式除去,水浸过滤后得到Na2CrO4溶液,
故答案为:Al2O3+2NaOH=2NaAlO2+H2O;
(3)该步骤是CrO42-到Cr2O72-的转化,反应的离子方程式为:2CrO42-+2H+=Cr2O72-+H2O,现象是溶液由黄色变成橙色,
故答案为:2CrO42-+2H+=Cr2O72-+H2O;溶液由黄色变成橙色;
(4)NaCl的溶解度受温度影响小,K2Cr2O7的溶解度受温度影响大,分离NaCl、K2Cr2O7,将混合物溶解后,先蒸发浓缩析出NaCl,趁热过滤防止K2Cr2O7晶体,滤液经过冷却结晶、过滤得到K2Cr2O7晶体,
故答案为:②蒸发;③过滤;高温.
点评 本题考查物质制备实验,为高频考点,注意根据各问题进行分析解答,涉及化学反应速率影响因素、物质的分离提纯,注意理解利用溶解度进行物质的分离,充分考查学生的分析、理解能力及化学实验能力,难度中等.

 智能训练练测考系列答案
智能训练练测考系列答案| A. | 硫化钠的电子式: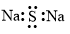 | |
| B. | HClO4的电离方程式:HClO4?H++ClO4- | |
| C. | 乙酸的结构简式:C2H4O2 | |
| D. | Mg2+的结构示意图: |
| A. | 足量铁在氯气中反应,1mol铁失去的电子数为3NA | |
| B. | 6.4g Cu与足量硫充分反应后,转移电子数为0.2NA | |
| C. | 密闭容器中2mol NO与1mol O2充分反应后,产物的分子数为NA | |
| D. | 常温常压下,0.1mol NH3与0.1mol HCl充分反应后所得产物含0.1NA个分子 |
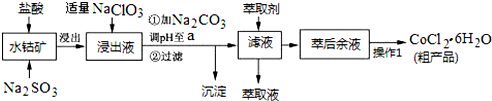
已知:①浸出液中含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的两种沉淀的化学式为Fe(OH)3、Al(OH)3.
(4)制得的CoCl2•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(5)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B.
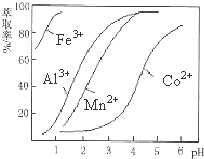
A.2.0~2.5 B.3.0~3.5 C.4.0~4.5 D.5.0~5.5
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)
(1)配制500mL 0.1mol/L 的盐酸
| 应量取的浓盐酸的体积/mL | 应选用的容量瓶的规格/mL | 除容量瓶外需要的其他仪器 |
A用适量蒸馏水洗涤烧杯和玻璃棒2~3次,洗涤液均注入容量瓶,振荡
B 用量筒准确量取所需的浓盐酸,沿玻璃棒倒入烧杯中,再加入适量蒸馏水,用玻璃棒搅拌,使其混合均匀
C 将已冷却的溶液沿玻璃棒注入所选容量瓶中
D 盖好瓶塞,上下颠倒摇匀
E 改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F 继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
(3)操作A中,将洗涤液都注入容量瓶,其目的是保证溶质全部转入容量瓶中,若无操作A,则所配溶液浓度偏小(填“偏大”、“偏小”或“不变”)
(4)E中加蒸馏水不慎超过了刻度线,则所配溶液浓度偏小(填“偏大”、“偏小”或“不变”),应如何处理重新配制.