题目内容
分别依据下列实验事实,得出的结论正确的是( )
| 实验事实 | 结论 | |
| A | 苯酚和水的浊液中,加碳酸钠溶液,溶液变澄清 | 苯酚的酸性比碳酸强 |
| B | 将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色 | 随溶液pH减小,“84”消毒液的氧化能力增强 |
| C | 铜放入稀硫酸中,无明显现象,再加入硝酸钠固体,溶液变蓝,有明显的气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
| D | 向2mL 0.1mol/L的硝酸银溶液中加入1mL0.1mol/L NaCl溶液,出现白色沉淀,再加入几滴0.1mol/L Na2S溶液,有黑色沉淀生成 | 氯化银的溶解度大于硫化银 |
| A、A | B、B | C、C | D、D |
考点:化学实验方案的评价
专题:实验评价题
分析:A.苯酚和水的浊液中,加碳酸钠溶液生成苯酚钠和碳酸氢钠;
B.酸性增强,次氯酸根离子的氧化性增强;
C.酸性条件下,硝酸根离子具有强氧化性;
D.硝酸银过量,不能证明.
B.酸性增强,次氯酸根离子的氧化性增强;
C.酸性条件下,硝酸根离子具有强氧化性;
D.硝酸银过量,不能证明.
解答:
解:A.苯酚和水的浊液中,加碳酸钠溶液生成苯酚钠和碳酸氢钠,不能证明苯酚的酸性比碳酸强,故A错误;
B.将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色,可说明酸性增强,次氯酸根离子的氧化性增强,故B正确;
C.酸性条件下,硝酸根离子具有强氧化性,可氧化铜,故C错误;
D.硝酸银过量,不能证明,可用等浓度的硝酸银和氯化钠溶液,然后再加入Na2S溶液,故D错误.
故选B.
B.将“84”消毒液(含NaClO)滴入品红溶液中,褪色缓慢,若同时加入食醋,红色很快褪为无色,可说明酸性增强,次氯酸根离子的氧化性增强,故B正确;
C.酸性条件下,硝酸根离子具有强氧化性,可氧化铜,故C错误;
D.硝酸银过量,不能证明,可用等浓度的硝酸银和氯化钠溶液,然后再加入Na2S溶液,故D错误.
故选B.
点评:本题考查较为综合,涉及酸性、氧化性以及难溶电解质的溶解平衡等问题,为高频考点,侧重学生的分析、实验能力的考查,注意把握实验的原理以及角度,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列表述正确的是( )
A、氢氧根离子的电子式是 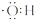 |
B、二氧化碳分子的比例模型是  |
| C、芳香烃的组成通式是CnH2n-6(n≥6) |
D、12C和14C的原子结构示意图均可表示为  |
MOH强碱和等体积、等浓度的HA弱酸溶液混合后,溶液中以下关系不正确的是( )
| A、c(M+)>c(A-)>c(OH-)>c(H+) |
| B、c(HA)+c(H+)=c(OH-) |
| C、c(M+)>c(A-)>c(H+)>c(OH-) |
| D、c(M+)=c(A-)+c(HA) |
某同学在配制500mL 0.5mol/LNaCl溶液的实验过程中,除用到天平、玻璃棒、烧杯、量筒、胶头滴管、试剂瓶之外,还需要的主要仪器有( )
| A、酒精灯 | B、蒸发皿 |
| C、500mL容量瓶 | D、温度计 |
下列实验操作错误的是( )
| A、用蒸馏的方法分离汽油和煤油 |
| B、分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| C、浓硫酸稀释时,应将浓硫酸慢慢加到水中,及时搅拌并冷却 |
| D、将O2和H2的混合气体通过灼热的氧化铜,以除去其中的H2 |