题目内容
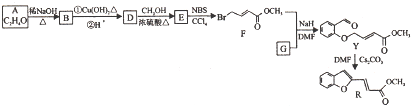
某同学设计了由乙醇合成乙二醇的路线如下.乙醇
X
Y
乙二醇
(1)X是 (填名称).
(2)X→Y的反应类型是 .
(3)写出Y→乙二醇的化学方程式 .
(4)等物质的量的乙醇、乙二醇完全燃烧,消耗氧气的物质的量之比是 .
| ① |
| Br2 |
| CCl4 |
| ② |
(1)X是
(2)X→Y的反应类型是
(3)写出Y→乙二醇的化学方程式
(4)等物质的量的乙醇、乙二醇完全燃烧,消耗氧气的物质的量之比是
考点:有机物的结构和性质,有机物的合成
专题:有机物的化学性质及推断
分析:由乙醇合成乙二醇的路线为乙醇发生消去反应生成乙烯,乙烯与溴发生加成生成二溴乙烷,二溴乙烷水解生成乙二醇,所以X为乙烯,Y为BrCH2CH2Br,根据CH3CH2OH和HOCH2CH2OH的分子式即可判断出它们消耗氧气的物质的量之比,据此答题.
解答:
解:由乙醇合成乙二醇的路线为乙醇发生消去反应生成乙烯,乙烯与溴发生加成生成二溴乙烷,二溴乙烷水解生成乙二醇,所以X为乙烯,Y为BrCH2CH2Br,
(1)根据上面的分析可知,X是乙烯,故答案为:乙烯;
(2)X→Y的反应类型是加成反应,故答案为:加成反应;
(3)Y→乙二醇的化学方程式为 ,
,
故答案为: ;
;
(4)因为每摩尔CH3CH2OH完全燃烧消耗3mol氧气,每摩尔HOCH2CH2OH完全燃烧消耗2.5mol氧气,所以等物质的量的CH3CH2OH和HOCH2CH2OH完全燃烧,消耗氧气的物质的量之比是3:2.5=6:5,
故答案为:6:5.
(1)根据上面的分析可知,X是乙烯,故答案为:乙烯;
(2)X→Y的反应类型是加成反应,故答案为:加成反应;
(3)Y→乙二醇的化学方程式为
 ,
,故答案为:
 ;
;(4)因为每摩尔CH3CH2OH完全燃烧消耗3mol氧气,每摩尔HOCH2CH2OH完全燃烧消耗2.5mol氧气,所以等物质的量的CH3CH2OH和HOCH2CH2OH完全燃烧,消耗氧气的物质的量之比是3:2.5=6:5,
故答案为:6:5.
点评:本题以有机物的合成考查有机物的结构与性质,题目难度不大,掌握乙醇和卤代烃的性质是解题的关键,答题时注意有机基础知识的灵活运用.

练习册系列答案
 同步练习强化拓展系列答案
同步练习强化拓展系列答案
相关题目
能用排水法收集的气体是( )
| A、CO2 |
| B、H2 |
| C、HCl |
| D、NH3 |
下列有关说法正确的是( )
| A、因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 |
| B、常温下,MgO(s)+C(s)=Mg(s)+CO(g)不能自发进行,则其△H>0 |
| C、在NaCl和KBr的混合溶液中滴加AgNO3溶液,一定先产生淡黄色沉淀 |
| D、加热0.1mol?L-1Al2(SO4)3溶液,水解程度增大、溶液的酸性增强 |


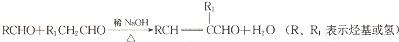
 互为同系物.
互为同系物.