题目内容
1.A、B、C、D、E五种物质的焰色都呈黄色,A、B与水反应都有气体放出,A与水反应放出的气体具有还原性,B与水反应放出的气体具有氧化性,同时都生成溶液C,C与适量的CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能生成D.(1)写出下列物质的化学式:BNa2O2,ENaHCO3.
(2)写出A→C的化学方程式,并标出电子转移的方向和数目:
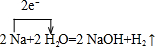 .
.(3)写出C→D的离子方程式:CO2+2OH-=CO32-+H2O.
(4)写出化学方程式:H2O+B→:2 H2O+2Na2O2=4NaOH+O2↑.
分析 A、B、C、D、E五种物质的焰色反应都呈黄色,均含Na元素,A、B与水反应都有气体放出,A与水反应放出的气体具有还原性,B与水反应放出的气体具有氧化性,则A为Na,B为Na2O2,同时都生成溶液C,则C为NaOH,C与适量CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能够生成D,则D为Na2CO3,E为NaHCO3.
解答 解:A、B、C、D、E五种物质的焰色反应都呈黄色,均含Na元素,A、B与水反应都有气体放出,A与水反应放出的气体具有还原性,B与水反应放出的气体具有氧化性,则A为Na,B为Na2O2,同时都生成溶液C,则C为NaOH,C与适量CO2反应生成D,D溶液与过量的CO2反应生成E,E加热能够生成D,则D为Na2CO3,E为NaHCO3.
(1)由上述分析可知,B为Na2O2,E为NaHCO3,故答案为:Na2O2;NaHCO3;
(2)A→C的化学方程式为2Na+2H2O=NaOH+2H2↑,标出电子转移的方向和数目: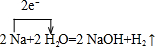 ,
,
故答案为: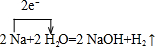 ;
;
(3)C→D的离子方程式:CO2+2OH-=CO32-+H2O,
故答案为:CO2+2OH-=CO32-+H2O;
(4)过氧化钠与水反应生成氢氧化钠与氧气,反应方程式为:2 H2O+2Na2O2=4NaOH+O2↑,
故答案为:2 H2O+2Na2O2=4NaOH+O2↑.
点评 本题考查无机物的推断,涉及Na及其化合物之间的转化,明确焰色反应及氢气具有还原性、氧气具有氧化性推断A、B为解答的关键,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
1.以下条件最有利于反应的自发进行的是( )
| A. | △S>0,△H>0 | B. | △S<0,△H<0 | C. | △S<0,△H>0 | D. | △S>0,△H<0 |
9.现有一包铁粉和铜粉混合均匀的粉末样品,为确定其组成,某兴趣小组同学将不同质量的该样品分别与40mL 1mol/L的FeCl3溶液反应,实验结果如下表所示(忽略反应前后溶液体积的微小变化).
(1)实验①反应后溶液中含有的金属阳离子有Fe3+、Fe2+、Cu2+.
(2)原粉末样品中m(Fe):m(Cu)=7:8.
| 实验序号 | ① | ② | ③ | ④ |
| M(粉末样品)/g | 0.90 | 1.80 | 3.60 | 7.20 |
| M(反应后剩余固体)/g | 0 | 0.64 | 2.48 | 6.08 |
(2)原粉末样品中m(Fe):m(Cu)=7:8.
16.下列除杂方法合理的是( )
| A. | 通过加热法除去Na2CO3固体中的NaHCO3 | |
| B. | 通过NaOH溶液除去CO2中的HCl | |
| C. | FeCl3溶液中加入铁粉可以除去溶液中的含有的Fe2+ | |
| D. | 通过饱和碳酸钠溶液除去CO2中混有的SO2 |
6.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 128gC60中含有90NA个分子 | |
| B. | 46g NO2和N2O4的混合气体含有的原子数为3NA | |
| C. | 标准状况下,22.4L CCl4所含的分子数为6.02×1023 | |
| D. | 100mL0.1 mol•L-1CaCl2溶液中Cl-的物质的量浓度为0.01 mol•L-1 |
10.下列关于胶体的叙述,不正确的是( )
| A. | 胶体中分散质粒子直径大小在1~100 nm之间 | |
| B. | 可以利用丁达尔效应区分胶体和溶液 | |
| C. | 可利用过滤的方法分离胶体和溶液 | |
| D. | 胶体在一定条件下可以稳定存在 |
