题目内容
6.设NA为阿伏加德罗常数的值,下列说法中正确的是( )| A. | 128gC60中含有90NA个分子 | |
| B. | 46g NO2和N2O4的混合气体含有的原子数为3NA | |
| C. | 标准状况下,22.4L CCl4所含的分子数为6.02×1023 | |
| D. | 100mL0.1 mol•L-1CaCl2溶液中Cl-的物质的量浓度为0.01 mol•L-1 |
分析 A、C60的摩尔质量为720g/mol;
B、NO2和N2O4的最简式均为NO2;
C、标况下四氯化碳为液态;
D、1mol氯化钙中含2mol氯离子来分析.
解答 解:A、C60的摩尔质量为720g/mol,128gC60的物质的量为n=$\frac{128g}{720g/mol}$=0.178mol,故含有的C60的分子个数为0.178NA个,故A错误;
B、NO2和N2O4的最简式均为NO2,故46g混合物中含有的NO2的物质的量为1mol,则含3mol原子即3NA个,故B正确;
C、标况下四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、1mol氯化钙中含2mol氯离子,故0.1mol/L氯化钙溶液中氯离子的浓度是氯化钙浓度的2倍,故溶液中氯离子的浓度为0.02mol/L,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
6.25℃时,某溶液的c(OH-)=10-5mol•L-1,其PH值为( )
| A. | 5 | B. | 9 | C. | 7 | D. | 14 |
17.在一定的温度下,向一密闭容器中放入 1mol A 和 1mol B,发生下列反应:A(g)+B(g)?C(g)+2D(g),达到平衡状态时,C的含量为 m%,保持温度和体积不变,若按照下列配比在上述容器放入起始物质,达到平衡状态时C的含量仍然为m%的是( )
| A. | 2mol A+1mol B | |
| B. | 1mol C+1mol D | |
| C. | 2mol C+2mol D | |
| D. | 0.5mol A+0.5mol B+0.5mol C+1mol D |
14.在汽车排气管加装催化装置,可有效减少CO和NOx的排放,催化装置内发生反应为:NOx+CO$\stackrel{催化剂}{→}$N2+CO2(未配平),下列关于此反应的说法中错误的是( )
| A. | 当x=2时,每生成lmolN2,转移电子数为4mol | |
| B. | 该反应中化合价变化的有N和C元素 | |
| C. | 等物质的量N2和C02中,共用电子对的个数比为3:4 | |
| D. | 氧化剂与还原剂的物质的量之比为1:1时,NOx中氮元素的化合价为+2价 |
18.在蒸发皿中加热蒸干再加热(低400℃)下列物质的溶液,可以得到该物质固体的是( )
| A. | AlCl3 | B. | Na2CO3 | C. | Na2SO3 | D. | MgSO4 |
15.以下反应属于氧化还原反应的是( )
| A. | CaO+H2O═Ca(OH)2 | B. | 2NH4HCO3$\stackrel{△}{→}$2NH3↑+H2O+CO2↑ | ||
| C. | 4HCl+O2$\stackrel{△}{→}$2H2O+2Cl2 | D. | NaHCO3+NaHSO4═Na2SO4+CO2↑+H2O |
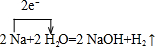 .
.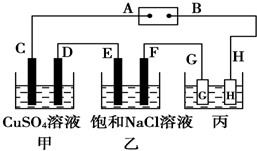 如图所示的装置,C、D、E、F都是惰性 电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答以下问题:
如图所示的装置,C、D、E、F都是惰性 电极.将电源接通后,向乙中滴入酚酞试液,在F极附近显红色.试回答以下问题: