题目内容
15.A、B、X、Y、Z、W六种短周期主族元素,A是地壳中含量最多的金属元素,短周期主族元素中B的原子半径最大,X、Y、Z、W元素在周期表中的相对位置如图所示,其中Z元素原子最外层电子数是电子层数的2倍.请回答下列问题:| X | Y | |
| Z | W |
 .
.(2)A、B各自最高价氧化物对应的水化物反应的化学方程式为Al(OH)3+NaOH═NaAlO2+2H2O.
(3)AW3可用于净水,其原理是Al3++3H2O?Al(OH)3(胶体)+3H+.(请用离子方程式表示)
(4)工业合成X的简单气态氢化物是放热反应.下列措施中既能提高反应速率,又能提高原料转化率的是d.
a.升高温度 b.加入催化剂 c.将X的简单气态氢化物及时移离
d.增大反应体系的压强
(5)标准状况下,2.24L X的简单气态氢化物被100mL l.0mol•L-1X的最高价氧化物对应的水化物溶液吸收后,所得溶液中离子浓度从大到小的顺序是(用离子符号表示)c(NO3-)>c(H+)>c(NH4+)>c(OH-);.
(6)WY2在杀菌消毒的同时,可将剧毒氰化物氧化成无毒气体而除去,写出用WY2(沸点9.9℃)氧化除去CN-的离子方程式2ClO2+2CN-═N2+2CO2+2Cl-.
分析 A、B、X、Y、Z、W六种短周期主族元素,A是地壳中含量最多的金属元素,则A为Al;短周期主族元素中B的原子半径最大,则B为Na;由X、Y、Z、W元素在周期表中的相对位置可知,X、Y处于第二周期,Z、W处于第三周期,Z元素原子最外层电子数是电子层数的2倍,则Z最外层电子数为6,处于Ⅵ族,故Z为S,则X为N、Y为O、W为Cl.
解答 解:A、B、X、Y、Z、W六种短周期主族元素,A是地壳中含量最多的金属元素,则A为Al;短周期主族元素中B的原子半径最大,则B为Na;由X、Y、Z、W元素在周期表中的相对位置可知,X、Y处于第二周期,Z、W处于第三周期,Z元素原子最外层电子数是电子层数的2倍,则Z最外层电子数为6,处于Ⅵ族,故Z为S,则X为N、Y为O、W为Cl,
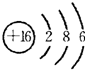
(1)Cl的最高价为+7,故最高价氧化物化学式是Cl2O7;Z为S,原子结构示意图为 ,
,
故答案为:Cl2O7; ;
;
(2)A、B各自最高价氧化物对应的水化物分别为:Al(OH)3、NaOH,二者反应生成偏铝酸钠与水,反应的化学方程式为Al(OH)3+NaOH═NaAlO2+2H2O,
故答案为:Al(OH)3+NaOH═NaAlO2+2H2O;
(3)AlCl3溶于水,Al3+水解:Al3++3H2O?Al(OH)3(胶体)+3H+,生成氢氧化铝胶体,具有吸附性,起净水作用,
故答案为:Al3++3H2O?Al(OH)3(胶体)+3H+;
(4)工业合成氨气是放热反应,且是体积减小的反应,
a.升高温度,反应速率加快,但平衡向逆反应方向移动,原料的转化率降低,故a错误;
b.加入催化剂,加快反应速率,平衡不移动,原料的转化率不变,故b错误;
c.将氨气及时移离,平衡向正反应方向移动,原料的转化率增大,但反应速率减慢,故c错误;
d.增大反应体系的压强,反应速率加快,平衡向正反应方向移动,原料转化率增大,故d正确,
故答案为:d;
(5)2.24L(标准状况)NH3为0.1mol,200mL 1mol/L HNO3溶液含有HNO3 0.2mol,氨气被硝酸溶液吸收,溶液相当于含有0.1mol HNO3与0.1mol NH4NO3混合,铵根离子水解,溶液呈酸性,水解程度微弱,所得溶液中离子浓度从大到小的顺序是c(NO3-)>c(H+)>c(NH4+)>c(OH-),
故答案为:c(NO3-)>c(H+)>c(NH4+)>c(OH-);
(6)ClO2在杀菌消毒的同时,可将剧毒氰化物氧化成无毒气体而除去,应生成氮气、二氧化碳,自身为还有为氯离子,除去CN-的离子方程式为:2ClO2+2CN-═N2+2CO2+2Cl-,
故答案为:2ClO2+2CN-═N2+2CO2+2Cl-.
点评 本题考查结构位置性质关系应用,题目难度中等,涉及常用化学用语、盐类水解、离子浓度大小比较、反应速率与化学平衡影响因素等知识,正确推断元素的种类为解答关键,注意熟练掌握原子结构与元素周期表、元素周期律的关系.

| A. | 胶体粒子带电荷并且在一定条件下能稳定存在 | |
| B. | 胶体的分散质粒子直径在1nm~100nm之间 | |
| C. | 胶体粒子不能穿过半透膜,能通过滤纸空隙 | |
| D. | 胶体粒子能够发生布朗运动而且能产生丁达尔现象 |
| A. |  干燥Cl2 | B. |  证明氨气极易溶于水 | ||
| C. |  检验K2CO3中的K+ | D. |  实验室制取氨气 |
| A. | HCl | B. | CH4 | C. | CH2=CH2 | D. | Cl2 |
| A. | 44 g CO2 气体中含有原子数为2NA | |
| B. | 常温常压下22.4 L H2 中含原子数为2NA | |
| C. | 64g二氧化硫含有原子数为3NA | |
| D. | 标准状况下22.4 L H2O中含分子数为NA |

 )中的π-键不能自由旋转,因此
)中的π-键不能自由旋转,因此 和
和 是两种不同的化合物,互为顺反异构体.则分子式为C3H4Cl2的化合物的烯烃异构体有( )
是两种不同的化合物,互为顺反异构体.则分子式为C3H4Cl2的化合物的烯烃异构体有( )