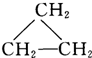
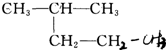题目内容
10.下图所示的实验操作,不能达到实验目的是( )| A. |  干燥Cl2 | B. |  证明氨气极易溶于水 | ||
| C. |  检验K2CO3中的K+ | D. |  实验室制取氨气 |
分析 A.氯气可用浓硫酸干燥,且从长管进气;
B.烧瓶内因氨气溶于水而导致压强减小;
C.观察钾离子的焰色反应,应透过蓝色钴玻璃;
D.应用氯化铵和氢氧化钙制备氨气.
解答 解:A.氯气可用浓硫酸干燥,且从长管进气,操作正确,可完成实验,故A正确;
B.烧瓶内因氨气溶于水而导致压强减小,气体变大,可完成实验,故B正确;
C.观察钾离子的焰色反应,应透过蓝色钴玻璃,以排出钠离子的干扰,故C正确;
D.氯化铵分解生成的氯化氢和氨气可重新生成氯化铵,应用氯化铵和氢氧化钙制备氨气,故D错误.
故选D.
点评 本题考查化学实验方案的评价,涉及气体的制备、喷泉实验以及焰色反应等知识,侧重于学生的分析能力、实验能力和评价能力的考查,为高考常见题型和高频考点,注意把握物质的性质的异同以及实验的严密性和合理性,难度不大.

练习册系列答案
相关题目
20.下列反应中符合图示能量变化的是( )
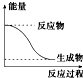

| A. | 电解Al2O3得到Al和O2 | B. | Ba(OH)2•8H2O与NH4Cl反应 | ||
| C. | 铝热反应 | D. | 灼热的炭与CO2反应 |
1.工业上粗硅的生产原理为2C+SiO2$\frac{\underline{\;高温\;}}{\;}$Si+2CO↑,下列说法正确的是( )
| A. | SiO2是氧化剂 | B. | SiO2发生氧化反应 | ||
| C. | C表现出氧化性 | D. | C被还原 |
18.关于氨的下列叙述中,正确的是( )
| A. | 氨具有还原性,可以被氧化为NO | |
| B. | 氨因为有刺激性气味,因此不用来作制冷剂 | |
| C. | 氨极易溶于水,因此氨水比较稳定(不容易分解) | |
| D. | 氨溶于水显弱碱性,因此可使石蕊试液变为红色 |
15.A、B、X、Y、Z、W六种短周期主族元素,A是地壳中含量最多的金属元素,短周期主族元素中B的原子半径最大,X、Y、Z、W元素在周期表中的相对位置如图所示,其中Z元素原子最外层电子数是电子层数的2倍.请回答下列问题:
(1)W的最高价氧化物化学式是Cl2O7;Z的原子结构示意图为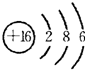 .
.
(2)A、B各自最高价氧化物对应的水化物反应的化学方程式为Al(OH)3+NaOH═NaAlO2+2H2O.
(3)AW3可用于净水,其原理是Al3++3H2O?Al(OH)3(胶体)+3H+.(请用离子方程式表示)
(4)工业合成X的简单气态氢化物是放热反应.下列措施中既能提高反应速率,又能提高原料转化率的是d.
a.升高温度 b.加入催化剂 c.将X的简单气态氢化物及时移离
d.增大反应体系的压强
(5)标准状况下,2.24L X的简单气态氢化物被100mL l.0mol•L-1X的最高价氧化物对应的水化物溶液吸收后,所得溶液中离子浓度从大到小的顺序是(用离子符号表示)c(NO3-)>c(H+)>c(NH4+)>c(OH-);.
(6)WY2在杀菌消毒的同时,可将剧毒氰化物氧化成无毒气体而除去,写出用WY2(沸点9.9℃)氧化除去CN-的离子方程式2ClO2+2CN-═N2+2CO2+2Cl-.
| X | Y | |
| Z | W |
 .
.(2)A、B各自最高价氧化物对应的水化物反应的化学方程式为Al(OH)3+NaOH═NaAlO2+2H2O.
(3)AW3可用于净水,其原理是Al3++3H2O?Al(OH)3(胶体)+3H+.(请用离子方程式表示)
(4)工业合成X的简单气态氢化物是放热反应.下列措施中既能提高反应速率,又能提高原料转化率的是d.
a.升高温度 b.加入催化剂 c.将X的简单气态氢化物及时移离
d.增大反应体系的压强
(5)标准状况下,2.24L X的简单气态氢化物被100mL l.0mol•L-1X的最高价氧化物对应的水化物溶液吸收后,所得溶液中离子浓度从大到小的顺序是(用离子符号表示)c(NO3-)>c(H+)>c(NH4+)>c(OH-);.
(6)WY2在杀菌消毒的同时,可将剧毒氰化物氧化成无毒气体而除去,写出用WY2(沸点9.9℃)氧化除去CN-的离子方程式2ClO2+2CN-═N2+2CO2+2Cl-.
19.短周期元素X、Y、Z、W的原子序数依次增大,X原子在元素周期表中原子半径最小,Y的次外层电子数是最外层的$\frac{1}{3}$,ZX2是一种储氢材料,W与Y属于同一主族.下列叙述正确的是( )
| A. | 原子半径:rW>rZ>rY | |
| B. | 化合物X2Y、ZY、ZX2中化学键的类型相同 | |
| C. | 由X、Y、Z、W组成的化合物的水溶液可能显酸性 | |
| D. | 由Y元素形成的离子与W元素形成的离子的电子数不可能相同 |
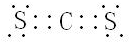 (用元素符号表示),D原子的基态原子核外电子排布式为1s22s22p63s23p4;
(用元素符号表示),D原子的基态原子核外电子排布式为1s22s22p63s23p4;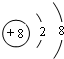 .
. ⑥
⑥