题目内容
 现有部分前四周期元素的性质、原子结构如下表:
现有部分前四周期元素的性质、原子结构如下表:| 元素 编号 | 元素性质、原子结构 |
| A | 第三周期中的半导体材料 |
| B | L层s电子数比p电子数少1 |
| C | 第三周期主族元素中其电负性最大 |
| D | 元素的2p轨道无空轨道,且有两个单电子 |
元素B的气态氢化物的VSEPR模型为
(2)这四种元素形成的单质晶体的沸点从高到低顺序为
(3)BC3分子晶体中B原子的杂化轨道类型为
(4)元素B的10e-氢化物与元素C的18e-的氢化物反应得到的产物的晶体类型为
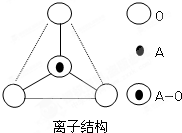
(5)如图所示某A与氧离子的空间结构示意图(虚线不表示共价键).通过观察分析,下列叙述正确的有
A、键角为120℃B、化学组成为SiO32-
C、键角为109°28′D、化学组成为SiO44-.
考点:位置结构性质的相互关系应用,原子核外电子排布,原子轨道杂化方式及杂化类型判断
专题:元素周期律与元素周期表专题,化学键与晶体结构
分析:A是第三周期中的半导体材料,A为硅元素,B的L层s电子数比p电子数少1,则B为氮元素,C为第三周期主族元素中其电负性最大,则C为氯元素,D元素的2p轨道无空轨道,且有两个单电子,则D为氧元素,据此答题.
解答:
解:A是第三周期中的半导体材料,A为硅元素,B的L层s电子数比p电子数少1,则B为氮元素,C为第三周期主族元素中其电负性最大,则C为氯元素,D元素的2p轨道无空轨道,且有两个单电子,则D为氧元素,
(1)B常见单质为氮气,分子的电子式为 ,含有σ键和π键个数比为1:2,在氨分子中由于氮原子的价层电子对数为
,含有σ键和π键个数比为1:2,在氨分子中由于氮原子的价层电子对数为
=4,所以分子的VSEPR模型为 四面体型,由于氨气与水反应程度大,且为极性分子与水分子相同,以及与水分子之间形成氢键,所以氨气的溶解度最大,而Cl2、O2的极性与水不同,但Cl2能与水反应,所以Cl2的溶解度比氧气大,
故答案为: ;1:2;四面体;氨气与水反应程度大,且为极性分子与水分子相同,以及与水分子之间形成氢键;Cl2、O2的极性与水不同,但Cl2能与水反应;
;1:2;四面体;氨气与水反应程度大,且为极性分子与水分子相同,以及与水分子之间形成氢键;Cl2、O2的极性与水不同,但Cl2能与水反应;
(2)由于硅是原子晶体,氧气、氯气、氮气都是分子晶体,但相对分子质量氯气大于氧气大于氮气,所以分子间作用力氯气大于氧气大于氮气,根据晶体的类型和对应破坏的作用大小等因素可知,这四种元素形成的单质晶体的沸点从高到低顺序为Si>Cl2>O2>N2,
故答案:Si>Cl2>O2>N2;晶体的类型和对应破坏的作用大小等因素;
(3)NCl3分子晶体中N原子的价层电子对数为
=4,所以N原子的杂化轨道类型为sp3杂化,用电子式表示NCl3形成过程为 ,
,
故答案为:sp3杂化; ;
;
(4)元素B的10e-氢化物为氨气,元素C的18e-的氢化物为氯化氢,它们反应得到的产物为氯化铵,是离子晶体类型,
故答案为:离子晶体;
(5)根据题中图所示,每个硅原子周围有四个氧原子,所以键角为109°28′,根据化合价和原子数可知,该微粒的组成为SiO44-,故选CD;
(1)B常见单质为氮气,分子的电子式为
 ,含有σ键和π键个数比为1:2,在氨分子中由于氮原子的价层电子对数为
,含有σ键和π键个数比为1:2,在氨分子中由于氮原子的价层电子对数为| 5+3 |
| 2 |
故答案为:
 ;1:2;四面体;氨气与水反应程度大,且为极性分子与水分子相同,以及与水分子之间形成氢键;Cl2、O2的极性与水不同,但Cl2能与水反应;
;1:2;四面体;氨气与水反应程度大,且为极性分子与水分子相同,以及与水分子之间形成氢键;Cl2、O2的极性与水不同,但Cl2能与水反应;(2)由于硅是原子晶体,氧气、氯气、氮气都是分子晶体,但相对分子质量氯气大于氧气大于氮气,所以分子间作用力氯气大于氧气大于氮气,根据晶体的类型和对应破坏的作用大小等因素可知,这四种元素形成的单质晶体的沸点从高到低顺序为Si>Cl2>O2>N2,
故答案:Si>Cl2>O2>N2;晶体的类型和对应破坏的作用大小等因素;
(3)NCl3分子晶体中N原子的价层电子对数为
| 5+3 |
| 2 |
 ,
,故答案为:sp3杂化;
 ;
;(4)元素B的10e-氢化物为氨气,元素C的18e-的氢化物为氯化氢,它们反应得到的产物为氯化铵,是离子晶体类型,
故答案为:离子晶体;
(5)根据题中图所示,每个硅原子周围有四个氧原子,所以键角为109°28′,根据化合价和原子数可知,该微粒的组成为SiO44-,故选CD;
点评:本题主要考查了电子式、分子空间构型、晶体的性质、晶体类型等知识,难度不大,解题的关键是元素推断,答题时注意基础知识的灵活运用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1gN2含a个分子,则阿伏加德罗常数的数值可表示为( )
A、
| ||
| B、a | ||
| C、28a | ||
D、
|
下列说法正确的是( )
| A、将浓度为0.1mol?L-1HF溶液加水不断稀释过程中,c(H+)和c(OH-)都会减小 |
| B、常温下,为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的PH,若PH>7,则H2A是弱酸;若PH<7,则H2A是强酸 |
| C、将SO2通入一定量的KOH溶液,所得溶液呈中性,该溶液中一定含KHSO2 |
| D、用0.2000mol?L-1NaOH标准溶液滴定浓度均为0.1mol?L-1的HCl与CH3COOH的混合液,至中性时,溶液中的酸恰好被完全中和 |
设NA为阿伏伽德罗常数的数值,下列说法正确的是( )
| A、1mol NaCl中,Na+的核外电子总数为10NA |
| B、1molFe与过量的稀HNO3反应,转移2NA个电子 |
| C、0.1mol?L?1Na2SO4液含有0.1NA个SO42- |
| D、常温常压下,22.4L氯气与足量镁粉充分反应,生成MgCl2 2NA |