题目内容
6.已知热化学方程式:①2C2H2(g)+5O2(g)═4CO2(g)+2H2O( l )△H1=-2602.0kJ•mol-1
②C(s)+O2(g)═CO2( g )△H2=-393.5kJ•mol-1
③H2(g)+$\frac{1}{2}$O2(g)═H2O( l )△H3=-285.8kJ•mol-1
则反应④2C(s)+H2(g)═C2H2( g )的△H为+228.2 kJ•mol-1.
分析 利用盖斯定律,将②×2+③-$\frac{1}{2}$①即得到反应④,反应热为△H=2△H2+△H3-$\frac{1}{2}$△H1,以此解答该题.
解答 解:根据盖斯定律可知,②+③-①即得到反应④2C(s)+H2(g)═C2H2(g),所以该反应的△H=-393.5 kJ•mol-1×2-285.8 kJ•mol-1+$\frac{1}{2}$×2602.0kJ•mol-1=+228.2 kJ•mol-1,故答案为:+228.2 kJ•mol-1.
点评 本题考查反应热的计算,注意根据已知热化学方程式利用盖斯定律计算反应热的方法,答题时注意体会,题目难度不大.

练习册系列答案
相关题目
16.设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A. | 1 L 0.1 mol•L-1的氨水中含有NH3•H2O分子数为0.1NA | |
| B. | 电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA | |
| C. | 标准状况下,2.24 L的二氯甲烷中含有的碳氯共价键的数目为0.2NA | |
| D. | 一定条件下,4.6 g NO2和N2O4混合气体中含有的N原子数目为0.1NA |
17.元素在周期表中的位置,反映了元素的原子结构和元素的性质.下列说法正确的( )
| A. | 同一元素不可能既表现金属性,又表现非金属性 | |
| B. | 同一主族的元素的原子,最外层电子数相同,化学性质完全相同 | |
| C. | 短周期元素形成离子后,最外层都达到8电子稳定结构 | |
| D. | 第三周期主族元素的最高正化合价等于它所处的主族序数 |
14.下列说法中正确的是( )
| A. | 标准状况下,3.36 L煤油含有9.03×1022个煤油分子 | |
| B. | 常温常压下,2 g氢气含有的原子数为1.204×1024个 | |
| C. | 同温同压下,相同体积的任何气体所含的原子数相等 | |
| D. | 22.4 L气体所含分子数一定大于11.2 L气体所含分子数 |
1.常温下,将pH=8的NaOH与pH=10的NaOH溶液等体积混合后,溶液后c(H+)最接近于( )
| A. | (10-8+10-10)mol/L | B. | (10-4+10-6)mol/L | C. | (10-8+10-9)mol/L | D. | 2×10-10mol/L |
11.在一定条件下,CaCO3(块状)+2HCl═CaCl2+H2O+CO2反应中,为了加快反应的速率,下列方法可行的是( )
| A. | 增加HCl的浓度 | B. | 加水 | ||
| C. | 增加同浓度盐酸的体积 | D. | 增加压强 |
18.常温下用 pH试纸测得氨水的pH等于12,则该溶液的物质的量浓度是( )
| A. | 12mol/L | B. | 1×10-12mol/L | C. | 0.01mol/L | D. | 大于0.01mol/L |
15.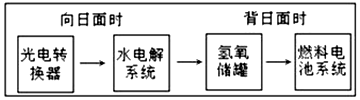 如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
 如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )
如图是某空间站能量转化系统的局部示意图,其中燃料电池采用KOH为电解液,下列有关说法中不正确的是( )| A. | 该能量转化系统中的水也是可能循环的 | |
| B. | 燃料电池系统将电能转化为化学能 | |
| C. | 水电解系统中的阳极反应:4OH-═2H2O+O2↑+4e- | |
| D. | 燃料电池放电时的负极反应:H2+2OH-═2H2O+2e- |