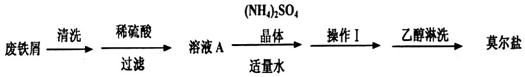
题目内容
20.某种苯的同系物0.1mol在足量的氧气中完全燃烧,将产生的高温气体依次通过浓硫酸和氢氧化钠溶液,使浓硫酸增重7.2g,氢氧化钠溶液增重30.8g.推测它的分子式和结构简式.分析 根据浓硫酸增重的为水的质量,氢氧化钠增重的为二氧化碳的质量,根据n=$\frac{m}{M}$计算出水、二氧化碳的物质的量,从而得出芳香烃的分子中含有的C、H原子数,确定其的分子式及结构简式.
解答 解:苯的同系物完全燃烧生成的气体通过浓硫酸和氢氧化钠时,浓硫酸吸收水蒸气,氢氧化钠吸收二氧化碳,故0.1mol苯的同系物燃烧生成水7.2g,二氧化碳30.8g,则n(H2O)=$\frac{7.2g}{18g/mol}$=0.4mol,根据原子守恒知,n(H)=2n(H2O)=0.8mol,n(CO2)=$\frac{30.8g}{44g/mol}$=0.7mol,所以n(苯的同系物):n(C):n(H)=0.1mol:0.7mol:0.8mol=1:7:8,苯的同系物的分子式为:C7H8,其结构简式为 ;
;
故答案为:C7H8, .
.
点评 本题考查了有机物分子式、结构式的确定,题目难度中等,注意掌握确定有机物分子式的方法,试题培养了学生灵活应用所学知识的能力.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
15.钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).
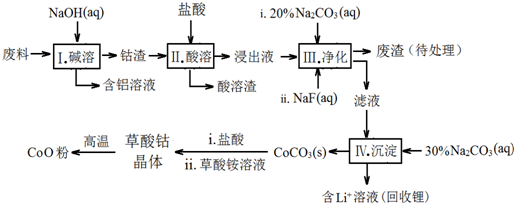
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)写出步骤Ⅱ中Co2O3与盐酸反应的离子方程式Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15.废渣中的成分有LiF,Fe(OH)3.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(5)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种二化合物,该化合物中钴元素的质量分数为73.44%.此过程发生反应的化学方程式是3CoC2O4+2O2$\frac{\underline{\;210-290℃\;}}{\;}$Co3O4+6CO2.
(6)某锂离子电池的总反应为C+LiCoO2$?_{放电}^{充电}$ LixC+Li1-xCoO2,LixC中Li的化合价为0价,该锂离子电池充电时阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+.

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)写出步骤Ⅱ中Co2O3与盐酸反应的离子方程式Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15.废渣中的成分有LiF,Fe(OH)3.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(5)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种二化合物,该化合物中钴元素的质量分数为73.44%.此过程发生反应的化学方程式是3CoC2O4+2O2$\frac{\underline{\;210-290℃\;}}{\;}$Co3O4+6CO2.
(6)某锂离子电池的总反应为C+LiCoO2$?_{放电}^{充电}$ LixC+Li1-xCoO2,LixC中Li的化合价为0价,该锂离子电池充电时阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+.
10.设阿伏加德罗常数为NA,则下列说法正确的是( )
| A. | 15g甲基(-CH3)所含有的电子数是NA | |
| B. | 常温常压下,4g氦气所含有的原子数目为NA | |
| C. | 标准状况下,1L己烷充分燃烧后生成的气态产物的分子数为$\frac{6}{22.4}$NA | |
| D. | 常温常压下,1mol丙烷所含有的共价键数目为12NA |
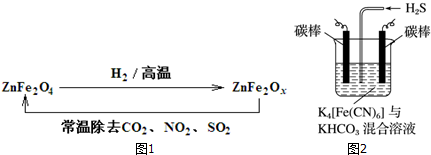
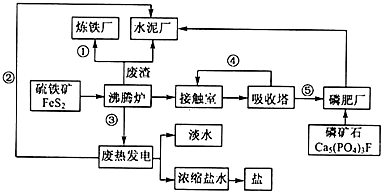 生态工业园区的建设,不仅仅是体现环保理念,重要依据循环经济理论和充分考虑经济的可持续发展,如图是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产生三大生态产业链流程图.
生态工业园区的建设,不仅仅是体现环保理念,重要依据循环经济理论和充分考虑经济的可持续发展,如图是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产生三大生态产业链流程图.