题目内容
1.常温下,将pH=8的NaOH与pH=10的NaOH溶液等体积混合后,溶液后c(H+)最接近于( )| A. | (10-8+10-10)mol/L | B. | (10-4+10-6)mol/L | C. | (10-8+10-9)mol/L | D. | 2×10-10mol/L |
分析 两种碱溶液混合,先计算出混合后溶液的c(OH-),再根据溶液的Kw计算出溶液的c(H+),由此分析解答.
解答 解:pH=8的NaOH溶液中c(OH-)=1×10-6mol/L,pH=10的NaOH溶液中c(OH-)=1×10-4mol/L,
混合后c(OH-)=$\frac{1{0}^{-6}+1{0}^{-4}}{2}$mol/L≈$\frac{1{0}^{-4}}{2}$mol/L,
则溶液中的c(H+)=$\frac{Kw}{c(O{H}^{-})}$=$\frac{\frac{1{0}^{-14}}{1{0}^{-4}}}{2}$mol/L=2.0×10-10mol/L,
故选D.
点评 本题考查两种碱溶液混合后的溶液氢离子浓度计算,题目难度不大,注意先计算溶液中c(OH-),再计算c(H+).

练习册系列答案
相关题目
16.在呼吸面具和潜水艇中可用过氧化钠作为供氧剂.请选用适当的化学试剂和实验用品,用如图中的实验装置进行实验,证明过氧化钠可用作供氧剂.
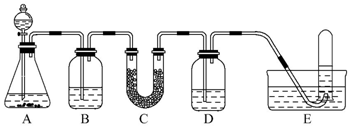
(1)A是制取CO2的装置.写出A中发生反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)填写表中空格:
(3)写出Na2O2与CO2反应的化学方程式:2Na2O2+2CO2=2Na2CO3+O2.
(4)试管中收集满气体后,下一步实验操作及现象、结论是把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管;把带火星的木条伸入试管内,木条复燃,证明管中收集的气体是O2.

(1)A是制取CO2的装置.写出A中发生反应的化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)填写表中空格:
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | 除去CO2中混有的HCl |
| C | ||
| D |
(4)试管中收集满气体后,下一步实验操作及现象、结论是把E中的导管移出水面,关闭分液漏斗活塞,用拇指堵住试管口,取出试管;把带火星的木条伸入试管内,木条复燃,证明管中收集的气体是O2.
13.下列叙述中不正确的是( )
| A. | 镀锡的铁皮,破损后铁皮反而易被腐蚀 | |
| B. | 纯铁比生铁更易被腐蚀 | |
| C. | 金属的电化腐蚀比化学腐蚀普遍 | |
| D. | 金属腐蚀的本质是M-ne-=Mn+而被损耗 |
10.下列离子方程式正确的是( )
| A. | Fe(OH)3溶于HI溶液中:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 磁性氧化铁溶于稀盐酸:Fe3O4+8H+═Fe3++2Fe2++4H2O | |
| C. | NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | 酸性高锰酸钾溶液和硫酸亚铁溶液反应:MnO4-+3Fe2++4H+═MnO2↓+3Fe3++2H2O |
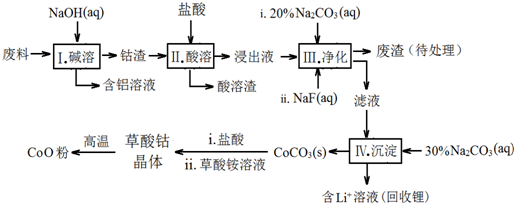
15.钴(Co)及其化合物在工业上有广泛应用.为从某工业废料中回收钴,某学生设计流程如下(废料中含有Al、Li、Co2O3和Fe2O3等物质).
已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
请回答:
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)写出步骤Ⅱ中Co2O3与盐酸反应的离子方程式Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15.废渣中的成分有LiF,Fe(OH)3.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(5)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种二化合物,该化合物中钴元素的质量分数为73.44%.此过程发生反应的化学方程式是3CoC2O4+2O2$\frac{\underline{\;210-290℃\;}}{\;}$Co3O4+6CO2.
(6)某锂离子电池的总反应为C+LiCoO2$?_{放电}^{充电}$ LixC+Li1-xCoO2,LixC中Li的化合价为0价,该锂离子电池充电时阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+.

已知:①物质溶解性:LiF难溶于水,Li2CO3微溶于水;
②部分金属离子形成氢氧化物沉淀的pH见下表:
| Fe3+ | Co2+ | Co3+ | Al3+ | |
| pH(开始沉淀) | 1.9 | 7.15 | -0.23 | 3.4 |
| pH(完全沉淀) | 3.2 | 9.15 | 1.09 | 4.7 |
(1)步骤Ⅰ中得到含铝溶液的反应的离子方程式是2Al+2OH-+2H2O=2AlO2-+3H2↑.
(2)写出步骤Ⅱ中Co2O3与盐酸反应的离子方程式Co2O3+6H++2Cl-=2Co2++Cl2↑+3H2O
(3)步骤Ⅲ中Na2CO3溶液的作用是调节溶液的pH,应使溶液的pH不超过7.15.废渣中的成分有LiF,Fe(OH)3.
(4)NaF与溶液中的Li+形成LiF沉淀,此反应对步骤Ⅳ所起的作用是降低溶液中Li+浓度,避免步骤Ⅳ中产生Li2CO3沉淀.
(5)在空气中加热CoC2O4固体,经测定,210~290℃的过程中只产生CO2和一种二化合物,该化合物中钴元素的质量分数为73.44%.此过程发生反应的化学方程式是3CoC2O4+2O2$\frac{\underline{\;210-290℃\;}}{\;}$Co3O4+6CO2.
(6)某锂离子电池的总反应为C+LiCoO2$?_{放电}^{充电}$ LixC+Li1-xCoO2,LixC中Li的化合价为0价,该锂离子电池充电时阳极的电极反应式为LiCoO2-xe-=Li1-xCoO2+xLi+.