题目内容
11.在一定条件下,CaCO3(块状)+2HCl═CaCl2+H2O+CO2反应中,为了加快反应的速率,下列方法可行的是( )| A. | 增加HCl的浓度 | B. | 加水 | ||
| C. | 增加同浓度盐酸的体积 | D. | 增加压强 |
分析 增大氢离子浓度、碳酸钙的接触面积、加热等,均可加快反应速率,以此来解答.
解答 解:A.增大盐酸的浓度,氢离子浓度增大,反应速率加快,故A正确;
B.加水,氢离子浓度减小,反应速率减小,故B错误;
C.增加同浓度盐酸的体积,浓度不变,则反应速率不变,故C错误;
D.反应在溶液中进行,增大压强,速率不变,故D错误.
故选A.
点评 本题考查影响化学反应速率的因素,为高频考点,把握常见的影响因素为解答的关键,题目难度不大.

练习册系列答案
相关题目
1.用下列方法测定空气中污染物的含量:将一定体积的空气通入吸收剂,并测定其电导的变化(导体的电阻愈大,它的电导愈小).如测定H2S的含量,若用CuSO4溶液吸收,可测定很大浓度范围内的H2S的含量,但电导变化不大;若用浓溴水吸收,仅限于测定低浓度范围内H2S的含量,但有很高的灵敏度.现要兼顾吸收容量与灵敏度的情况下测定空气中Cl2的含量,则应选用下列吸收剂中的( )
| A. | Na2S溶液 | B. | HI溶液 | C. | NaOH溶液 | D. | H2O |
19.下列各组离子在碱性条件下可以大量共存,在酸性条件下因发生氧化还原反应而不能大量共存的是( )
| A. | Cu2+ Fe2+ NO3- Cl- | B. | K+ Mg2+HCO3-SO42- | ||
| C. | S2- Na+ K+、Cl- | D. | Ba2+Na+ I- NO3- |
16.下列说法正确的是( )
| A. | 钢铁发生电化腐蚀的负极反应式:Fe-3e-═Fe3+ | |
| B. | 氢氧燃料电池的正极反应式:O2+2H2O+4e-═4OH- | |
| C. | 铜上镀锌时,与电源正极相连的是纯铜 | |
| D. | 用惰性电极电解饱和食盐水时,阴极的电极反应式为:2Cl--2e-═Cl2↑ |
20.在标准状况下,下列物质所占体积最大的是( )
| A. | 98gH2SO4 | B. | 56gFe | C. | 44.8LHCI | D. | 6gH2 |
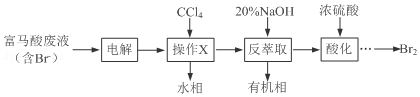
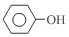 +3Br2→
+3Br2→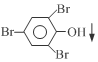 +3HBr
+3HBr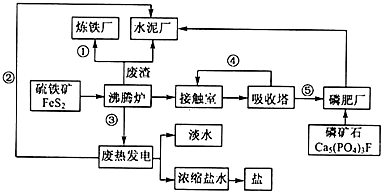 生态工业园区的建设,不仅仅是体现环保理念,重要依据循环经济理论和充分考虑经济的可持续发展,如图是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产生三大生态产业链流程图.
生态工业园区的建设,不仅仅是体现环保理念,重要依据循环经济理论和充分考虑经济的可持续发展,如图是某企业设计的硫酸-磷铵-水泥联产,海水-淡水多用,盐-热-电联产生三大生态产业链流程图.