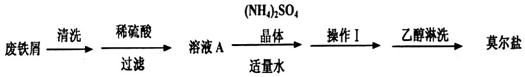
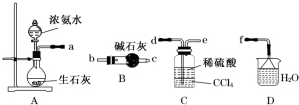
题目内容
18.常温下用 pH试纸测得氨水的pH等于12,则该溶液的物质的量浓度是( )| A. | 12mol/L | B. | 1×10-12mol/L | C. | 0.01mol/L | D. | 大于0.01mol/L |
分析 常温下用 pH试纸测得氨水的pH等于12,所以电离产生的氢氧根离子的浓度为0.01mol/L,而一水合氨是弱电解质,由此分析解答.
解答 解:常温下用 pH试纸测得氨水的pH等于12,所以电离产生的氢氧根离子的浓度为0.01mol/L,而一水合氨是弱电解质,部分电离,所以溶液的物质的量浓度大于0.01mol/L,故选D.
点评 本题考查溶液的PH的计算和弱电解质的电离,学生要清楚一水合氨是弱电解质,只有部分电离,比较容易.

练习册系列答案
相关题目
8.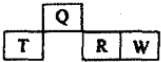 如图是元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法不正确的是( )
如图是元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法不正确的是( )
 如图是元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法不正确的是( )
如图是元素周期表中短周期的一部分,四种元素中只有一种是金属,下列说法不正确的是( )| A. | 气态氢化物的稳定性:W>R | |
| B. | 元素T的最高价氧化物水化物可能是强碱 | |
| C. | Q的原子半径比T小 | |
| D. | W和Q的原子序数相差10 |
13.下列叙述中不正确的是( )
| A. | 镀锡的铁皮,破损后铁皮反而易被腐蚀 | |
| B. | 纯铁比生铁更易被腐蚀 | |
| C. | 金属的电化腐蚀比化学腐蚀普遍 | |
| D. | 金属腐蚀的本质是M-ne-=Mn+而被损耗 |
10.下列离子方程式正确的是( )
| A. | Fe(OH)3溶于HI溶液中:Fe(OH)3+3H+═Fe3++3H2O | |
| B. | 磁性氧化铁溶于稀盐酸:Fe3O4+8H+═Fe3++2Fe2++4H2O | |
| C. | NaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| D. | 酸性高锰酸钾溶液和硫酸亚铁溶液反应:MnO4-+3Fe2++4H+═MnO2↓+3Fe3++2H2O |
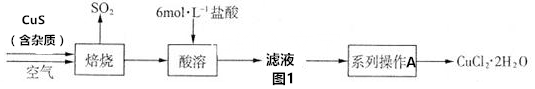


 +3Br2→
+3Br2→ +3HBr
+3HBr