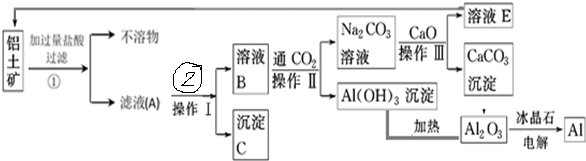
题目内容
7.有一种线性高分子,结构如图所示.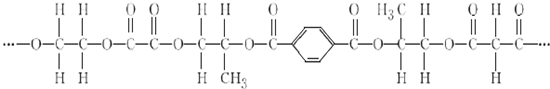
完成下列填空:
(1)该高分子由5种单体(聚合成高分子的简单小分子)聚合而成.
(2)写出上述单体中相对分子质量最小和相对分子质量最大的分子间发生缩聚反应的化学方程式nHO-CH2-CH2-OH+nHOOC-C6H5-COOH
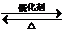
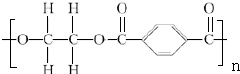 +2nH2O.
+2nH2O.(3)上述单体中相对分子质量最小的分子在一定条件下完全消去后所得物质的结构简式为CH≡CH.该物质加聚生成的高分子(填“能”或“不能”)能与溴的CCl4溶液发生加成反应.该物质三分子聚合成环,所得物质的名称是苯.
(4)上述单体中其中互为同系物的是(写出所有可能,用结构简式表述)HOOC-COOH与HOOC-CH2-COOH;HO-CH2-CH2-OH与
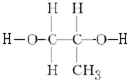 .
.(5)与上述单体中相对分子质量最大的物质互为同系物,且相对分子质量多14的结构有10种.
分析 由高聚物可知该有机物的单体有HO-CH2-CH2-OH、HOOC-COOH、 、
、 、HOOC-CH2-COOH等,结合对应有机物的结构和性质解答该题.
、HOOC-CH2-COOH等,结合对应有机物的结构和性质解答该题.
解答 解:(1)由高聚物可知该有机物的单体有:HO-CH2-CH2-OH、HOOC-COOH、 、
、 、HOOC-CH2-COOH等;
、HOOC-CH2-COOH等;
故答案为:5;
(2)上述单体中相对分子质量最小和相对分子质量最大的分别是:HO-CH2-CH2-OH、 ,二者反应的方程式为:
,二者反应的方程式为:
nHO-CH2-CH2-OH+nHOOC-C6H5-COOH +2nH2O;
+2nH2O;
故答案为:nHO-CH2-CH2-OH+nHOOC-C6H5-COOH +2nH2O;
+2nH2O;
(3)上述单体中式量最小的分子为HO-CH2-CH2-OH,在一定条件下完全消去后所得物质的结构简式为CH≡CH,含有不饱和键,可与溴发生加成反应,三分子CH≡CH聚合成环,可得到苯;
故答案为:CH≡CH;能;苯;
(4)互为同系物的是:HOOC-COOH与HOOC-CH2-COOH;HO-CH2-CH2-OH与 ;
;
故答案为:HOOC-COOH与HOOC-CH2-COOH;HO-CH2-CH2-OH与 ;
;
(5)相对分子质量最大的物质为 ,与之互为同系物,且相对分子质量多14,即多一个CH2,所以除了苯环外,
,与之互为同系物,且相对分子质量多14,即多一个CH2,所以除了苯环外,
取代基可能为:-CH(COOH)2,有1种结构;
取代基可能为:-COOH,-CH2COOH,存在邻、间、对3种结构;
取代基可能为:-COOH,-COOH,-CH3,2个-COOH在邻、间、对三种结构,-CH3再取代邻苯二甲酸中苯环上的一个氢原子,有2种结构,-CH3再取代间苯二甲酸中苯环上的一个氢原子,有3种结构,-CH3再取代对苯二甲酸中苯环上的一个氢原子,有1种结构,
所以符合条件的结构有10种,
故答案为:10.
点评 本题考查有机物的结构和性质,题目难度不大,注意根据高聚物判断有机物的单体为解答该题的关键,注意把握有机物的官能团的性质.

| A组 | B组 | C组 | D组 |
| 金刚石:3550 | Li:181 | HF:-83 | NaCl:801 |
| 硅晶体:1410 | Na:98 | HCl:-115 | KCl:776 |
| 硼晶体:2300 | K:64 | HBr:-89 | RbCl:718 |
| 二氧化硅:1723 | Rb:39 | HI:-51 | CaCl:645 |
(2)B组晶体共同的物理性质是①②③④(填序号).
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于HF分子间能形成氢键,其熔化时需要消耗的能量更多.
(4)D组晶体可能具有的性质是②④(填序号).
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点NaCl>KCl,其原因解释为:NaCl>KCl都为离子晶体,r(Na+)<r(K+),在离子所带电荷相同的情况下,半径越小,晶格能越大,熔点就越高.
| A. | 用水鉴别乙醇、甲苯和溴苯 | |
| B. | 用燃烧法鉴别乙醇、苯 | |
| C. | 用碳酸钠溶液鉴别乙醇、乙酸和乙酸乙酯 | |
| D. | 用酸性高锰酸钾溶液鉴别苯、环己烯和环己烷 |
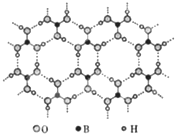 正硼酸(H3BO3)是一种层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法错误的是( )
正硼酸(H3BO3)是一种层状结构白色晶体,层内的H3BO3分子通过氢键相连(如图).下列有关说法错误的是( )| A. | 正硼酸晶体属于分子晶体 | B. | H3BO3分子的稳定性与氢键有关 | ||
| C. | 分子中硼原子最外层不是8e-结构 | D. | 含1mol H3BO3的晶体中有3mol氢键 |
①

②

| A. | ①② | B. | ① | C. | ② | D. | 均不正确 |
| 元素 | 相关信息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D | 室温下其单质为淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E | 它在地壳中储量丰富,是人体不可缺少的微量元素之一.其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
(2)化合物X是元素D的氢化物,X在水中的电离方程为H2S?H++HS-;元素E在元素周期表中的位置是第四周期第Ⅷ族.
(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2•CuCO3.某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50mol•L-1的Cu(NO3)2溶液、2.0mL 0.50mol•L-1的NaOH溶液和0.25mol•L-1的Na2CO3溶液按表Ⅰ所示体积混合.
实验2:将合适比例的混合物在表Ⅱ所示温度下反应.
实验记录如下:
| 编号 | V (Na2CO3)/mL | 沉淀情况 | 编号 | 反应温度/℃ | 沉淀情况 | |
| 1 | 2.8 | 多、蓝色 | 1 | 40 | 多、蓝色 | |
| 2 | 2.4 | 多、蓝色 | 2 | 60 | 少、浅绿色 | |
| 3 | 2.0 | 较多、绿色 | 3 | 75 | 较多、绿色 | |
| 4 | 1.6 | 较少、绿色 | 4 | 80 | 较多、绿色(少量褐色) |
①实验室制取少许孔雀石,应该采用的最佳条件是n[Cu(NO3)2]:n(Na2CO3)=2:1,75℃.
②80℃时,所制得的孔雀石有少量褐色物质的可能原因是Cu(OH)2受热分解为CuO.
(2)实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用如图所示的装置(夹持仪器省略)进行实验:
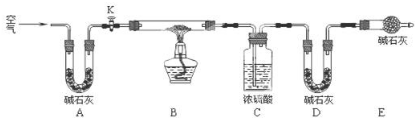
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中.
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量.
步骤3:加热装置B直至装置C中无气泡产生.
步骤4:(请补充该步操作内容).
步骤5:称量相关装置的质量.
①装置A的作用是;若无装置E,则实验测定的$\frac{x}{y}$的值将偏小(选填“偏大”、“偏小”或“无影响”).
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g
B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g
D.装置D实验后增重8.8g
为测定$\frac{x}{y}$的值,请你选用合适数据进行计算,并根据你的计算结果,写出该样品组成的化学式.