题目内容
17.碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2•yCuCO3.(1)孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2•CuCO3.某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50mol•L-1的Cu(NO3)2溶液、2.0mL 0.50mol•L-1的NaOH溶液和0.25mol•L-1的Na2CO3溶液按表Ⅰ所示体积混合.
实验2:将合适比例的混合物在表Ⅱ所示温度下反应.
实验记录如下:
| 编号 | V (Na2CO3)/mL | 沉淀情况 | 编号 | 反应温度/℃ | 沉淀情况 | |
| 1 | 2.8 | 多、蓝色 | 1 | 40 | 多、蓝色 | |
| 2 | 2.4 | 多、蓝色 | 2 | 60 | 少、浅绿色 | |
| 3 | 2.0 | 较多、绿色 | 3 | 75 | 较多、绿色 | |
| 4 | 1.6 | 较少、绿色 | 4 | 80 | 较多、绿色(少量褐色) |
①实验室制取少许孔雀石,应该采用的最佳条件是n[Cu(NO3)2]:n(Na2CO3)=2:1,75℃.
②80℃时,所制得的孔雀石有少量褐色物质的可能原因是Cu(OH)2受热分解为CuO.
(2)实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用如图所示的装置(夹持仪器省略)进行实验:
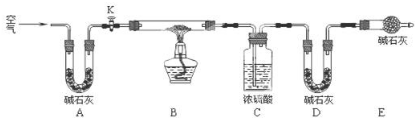
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中.
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量.
步骤3:加热装置B直至装置C中无气泡产生.
步骤4:(请补充该步操作内容).
步骤5:称量相关装置的质量.
①装置A的作用是;若无装置E,则实验测定的$\frac{x}{y}$的值将偏小(选填“偏大”、“偏小”或“无影响”).
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g
B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g
D.装置D实验后增重8.8g
为测定$\frac{x}{y}$的值,请你选用合适数据进行计算,并根据你的计算结果,写出该样品组成的化学式.
分析 (1)①根据表中碳酸钠的物质的量与硝酸铜的物质的量关系及最佳生成碱式碳酸铜温度完成;
②所制得的孔雀石有少量褐色物质是氧化铜,氢氧化铜分解生成了黑色的氧化铜;
(2)步骤4反应完毕后,需要继续通空气,让装置冷却;
①根据实验目的和碱石灰的作用分析;
②根据化学方程式找出与x、y有关的物质质量.
解答 解:(1)①由表中数据,0.25mol•L-1的碳酸钠溶液2mL时生成的孔雀石最多,杂质最少,此时n[Cu(NO3)2]:n(Na2CO3)=2:1;当温度在75℃,生成的孔雀石最多,杂质最少,
故答案为:n[Cu(NO3)2]:n(Na2CO3)=2:1,75℃;
②温度较高,氢氧化铜分解生成了氧化铜,所制得的孔雀石有少量褐色物质是氧化铜,
故答案为:Cu(OH)2受热分解为CuO;
(2)步骤4反应完毕后,需要继续通空气,让装置冷却,
故答案为:继续通一段时间空气至装置冷却;
①装置A碱石灰是干燥剂,可吸收空气中的水分,同时还能吸收空气中的二氧化碳,防止对装置CD增重的数据造成影响,装置E的作用是防止空气中的二氧化碳和水蒸气进入D装置,D装置是吸收生成的二氧化碳的,C装置是吸收生成的水的,如果没有装置E,会使D装置质量增重偏大,即生成的二氧化碳质量偏大,则x/y的值会偏小
故答案为:除去空气中的CO2和H2O; 偏小;
②碱式碳酸铜分解的化学方程xCu(OH)2•yCuCO3$\frac{\underline{\;\;△\;\;}}{\;}$(x+y)CuO+xH2O+yCO2↑
要测定$\frac{x}{y}$的值,可以测定生成的水和二氧化碳的质量,即测定C装置增重的质量和D装置增重的质量.故可选CD,
xCu(OH)2•yCuCO3$\frac{\underline{\;\;△\;\;}}{\;}$(x+y)CuO+xH2O+yCO2↑
18x 44y
9g 8.8g
$\frac{18x}{9g}$=$\frac{44y}{8.8g}$
$\frac{x}{y}$=$\frac{5}{2}$,
若测出反应后玻璃管中样品的质量以及装置C增重的质量,即已知方程式中氧化铜和水的质量关系,可求出$\frac{x}{y}$的值;故可选BC
xCu(OH)2•yCuCO3$\frac{\underline{\;\;△\;\;}}{\;}$(x+y)CuO+xH2O+yCO2↑
(x+y)×80 18x
56g 9g
$\frac{80(x+y)}{56g}$=$\frac{18y}{9g}$
$\frac{x}{y}$=$\frac{5}{2}$,
同样若已知反应后玻璃管中样品的质量以及装置C增重的质量,即已知方程式中氧化铜和二氧化碳的质量关系,可求出出$\frac{x}{y}$的值.故可可选BD
xCu(OH)2•yCuCO3$\frac{\underline{\;\;△\;\;}}{\;}$(x+y)CuO+xH2O+yCO2↑
(x+y)×80 44y
56g 8.8g
$\frac{80(x+y)}{56g}$=$\frac{44y}{8.8g}$,
$\frac{x}{y}$=$\frac{5}{2}$,
答:为测定$\frac{x}{y}$的值,选用合适数据为:BC、BD、CD;样品组成的化学式为5Cu(OH)2•2CuCO3.
点评 本题考碱式碳酸铜样品组成,涉及了根据化学方程式计算分析物质组成,浓硫酸增重的质量是生成的水的质量,碱石灰增重的质量是生成的二氧化碳的质量.

| A. | Na2SO4 | B. | SO2 | C. | Na2S | D. | H2SO4 |
| A. | 凡需要加热的反应一定是吸热反应 | |
| B. | 反应物的总能量不一定比生成物的总能量高 | |
| C. | 化学反应速率的大小主要取决于反应进行时的外界因素 | |
| D. | 催化剂都能加大化学反应速率,并提高原料的利用率和转化率 |
| A. | 0.5 molO2中约含有6.02×1023个O原子 | |
| B. | 1 mol H2SO4的质量是98g/mol | |
| C. | 0.5 molNa2CO3中含有1.5 mol CO32- | |
| D. | H2SO4的摩尔质量为98g |
| A. | 146C和167N的质子数相同,中子数不同 | |
| B. | 2814Si和2914Si的质子数相同,是同一种核素 | |
| C. | Na和K属于IA族元索,Na的金属性比K弱 | |
| D. | Cl和Br属于ⅧA族元素,两原子核外电子数之差为8 |
| A. | 3.2gO2和O3的混合物中含有的氧原子数目为0.2NA | |
| B. | 1L0.1mol/L的醋酸溶液中含有氢离子数目为0.1NA | |
| C. | 标准状况下,2.24LCCl4含碳原子数目为0.1NA | |
| D. | 常温常压下,2.24LC2H4和C2H2的混合气体中含碳原子数目为0.2NA |
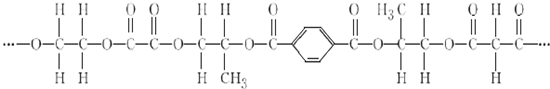
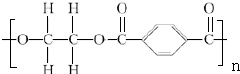 +2nH2O.
+2nH2O. .
.
 .
.