题目内容
4.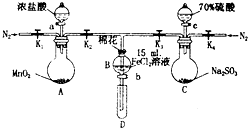 为验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).
为验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,关闭K2.
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子.
V.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程I的目的是排出装置中的空气,防止干扰.
(2)检验B中溶液是否还有Fe2+的方法之一是:取少量B中溶液于试管中,滴加几滴含有+3价铁元素的配合物溶液,会产生蓝色沉淀.写出该反应的离子方程式3Fe2++2(Fe(CN)6)3-=Fe3(Fe(CN)6)2↓.
(3)若向第III步B中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的离子方程式2Fe3++H2S═2Fe2++2H++S↓.
(4)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的化学方程式为2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4.
(5)甲、乙、丙三位同学分别完成了上述实验,结论如表所示.他们的检测结果一定不能够证明氧化性Cl2>Fe3+>SO2的是甲(填“甲”、“乙”或“丙”).
| 过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
分析 (1)通入一段时间N2,排出装置中的氧气;
(2)检验B中溶液是否还有Fe2+的方法,用二价铁与+3价铁元素的配合物溶液反应生成蓝色沉淀;
(3)第Ⅲ步B中发生三价铁离子与硫化氢反应,生成硫沉淀、二价铁、水;
(4)SO2通入酸性高锰酸钾溶液中二者可以发生氧化还原反应;
(5)乙中第一次,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫,丙中第一次有Fe3+,无Fe2+,则氯气的氧化性大于铁离子,第二次有亚铁离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫;
(6)根据电子守恒进行计算.
解答 解:(1)打开K1~K4,关闭K5、K6,通入一段时间N2,目的是排出装置中的氧气,
故答案为:排出装置中的空气,防止干扰;
(2)检验B中溶液是否还有Fe2+的方法,用二价铁与+3价铁元素的配合物溶液反应生成蓝色沉淀的离子方程式为:3Fe2++2(Fe(CN)6)3-=Fe3(Fe(CN)6)2↓,
故答案为:3Fe2++2(Fe(CN)6)3-=Fe3(Fe(CN)6)2↓;
(3)三价铁离子与硫化氢反应,生成硫沉淀、二价铁、水,离子方程式为:2Fe3++H2S═2Fe2++2H++S↓,
故答案为:2Fe3++H2S═2Fe2++2H++S↓;
(4)SO2具有还原性,酸性高锰酸钾溶液具有强的氧化性,二者混合后可以发生氧化还原反应:2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4,使高锰酸钾褪色,
故答案为:2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4;
(5)检测结果只能证明氧化性Cl2 >Fe3+,不能证明Fe3+>SO2,因为Cl2也能氧化SO2产生SO42-,乙中第一次,说明氯气不足,氯气氧化性大于铁离子,第二次有硫酸根离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫,丙中第一次有Fe3+,无Fe2+,则氯气的氧化性大于铁离子,第二次有亚铁离子,说明发生二氧化硫与铁离子的反应,则氧化性铁离子大于二氧化硫,检测结果甲只能证明氧化性Cl2 >Fe3+,不能证明Fe3+>SO2,因为Cl2也能氧化SO2产生SO42-,检测结果一定不能够证明氧化性Cl2>Fe3+>SO2的是甲,
故答案为:甲;
(6)设FeBr2的物质的量浓度为c,由电子守恒可知,$\frac{1.12L}{22.4L/mol}$×2×1=c×0.1L×(3-2)+c×0.1L×2×$\frac{1}{2}$×(1-0),解得c=0.5mol/L,
故答案为:0.5.
点评 本题考查性质实验方案的设计,涉及了氧化还原反应的判断、化学实验基本操作方法、氯气的制备、氯气、氯化铁和SO2性质的探究以及外界条件对平衡状态的影响等知识,题目难度中等,明确装置的作用及发生的反应是解答的关键,注意氧化性的比较是解答的难点.

 口算题天天练系列答案
口算题天天练系列答案| A. | C2H4 | B. | C3H8 | C. | C4H8 | D. | C5H10 |
| K218O2的质量 | O2的叙述 | |
| A | 57g | O2的质量为9g |
| B | 57g | 生成标准情况下O2的体积为5.6L |
| C | 114g | O2的摩尔质量是32g•mol-1 |
| D | 57g | 生成0.25molO2 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 1 mol SiO2晶体中,含有2NA个Si-O共价键 | |
| B. | 常温下,4.4 g CO2和N2O混合物中所含有的原子数为0.3 NA | |
| C. | 0.2 mol Cl2与足量的铁粉充分反应,转移电子数为0.6NA | |
| D. | 标准状况下,11.2 L 氯仿所含分子数为0.5 NA |
Ⅰ.请你利用原电池原理,设计实验,比较铜和铁的金属活动性.
实验用品:铁片、铜片、导线、金属夹、小灯泡、硫酸亚铁溶液、硫酸铜溶液、500mL烧杯.
画出实验装置简图,并标出正负极、电子流动方向.
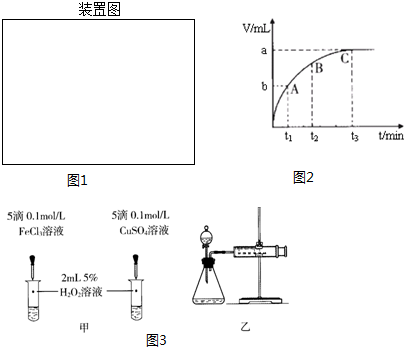
Ⅱ.为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入3mL 5% H2O2溶液,各滴入2滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡; 试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入3mL 5% H2O2溶液和3mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |
(2)实验①的目的是研究温度对H2O2分解速率的影响.
实验中滴加FeCl3溶液的目的是加快H2O2分解速率,使实验现象易于观察.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是将两支试管同时放入盛有相同温度热水的烧杯中,或向两支试管中同时滴入2滴1mol/LFeCl3溶液,观察产生气泡的速率(用实验中所提供的几种试剂).
(4)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图2所示,则A、B、C三点所表示的瞬时反应速率最慢的是C.
(5)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图3甲、乙所示的实验.请回答相关问题:
①定性分析:如图甲可通过观察溶液中气泡产生的速率,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是排除氯离子的干扰.
②定量分析:用图3乙所示装置做对照实验,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是收集40mL气体所需的时间.
 )是一种化学活性很高的烃,存在于煤焦油中.
)是一种化学活性很高的烃,存在于煤焦油中. $\stackrel{室温}{→}$
$\stackrel{室温}{→}$ ,反应类型为加成;该反应的产物除
,反应类型为加成;该反应的产物除 外,还有与双环戊二烯为同分异构体的其他副产物,写出其中一种的结构简式
外,还有与双环戊二烯为同分异构体的其他副产物,写出其中一种的结构简式 ;
; )是双环戊二烯的一种同分异构体,它的一氯代物有4种.
)是双环戊二烯的一种同分异构体,它的一氯代物有4种.
 R-CH2CH2OH(B2 H6为乙硼烷)
R-CH2CH2OH(B2 H6为乙硼烷) ;
; ;
;