题目内容
12.根据氧化还原反应和离子反应知识回答下列问题:Ⅰ.下列一组有水参与的反应:
①2Na+2H2O=2NaOH+H2↑
②2Na2O2+2H2O=4NaOH+O2↑
③Na2O+H2O=2NaOH
④3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$ Fe3O4+4H2
⑤2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑
⑥2F2+2H2O=4HF+O2
(1)其中不属于氧化还原反应的是③(填编号)
(2)在这些氧化还原反应中,水只作氧化剂的反应是①④(填编号);水既作氧化剂,又作还原剂是⑤(填编号).
(3)根据你的理解,氧化还原反应的实质是C
A.分子中的原子重新组合
B.氧元素的得失
C.电子的得失或共用电子对的偏移
D.化合价的改变.
分析 (1)有电子转移的化学反应是氧化还原反应,其特征是有元素化合价变化;
(2)水中元素得电子时作氧化剂,水中元素失电子时作还原剂,水中元素既得电子又失电子时作氧化剂和还原剂,反应中有电子转移且水中各元素化合价不变时,水既不是氧化剂又不是还原剂;
(3)氧化还原反应的实质是有电子转移.
解答 解:(1)氧化钠和水的反应中,各元素化合价都不变,所以该反应属于非氧化还原反应,
故答案为:③;
(2)①2Na+2H2O=2NaOH+H2↑中,水中氢元素化合价由+1价变为0价,钠元素化合价由0价变为+1价,所以水只作氧化剂;
②2Na2O2+2H2O=4NaOH+O2↑中,过氧化钠中氧元素化合价由-1价变为0价和-2价,所以过氧化钠既是氧化剂又是还原剂,水中各元素化合价不变,所以水既不是氧化剂也不是还原剂;
④3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2中,铁元素化合价由0价变为+2价和+3价,氢元素化合价由+1价变为0价,所以铁所还原剂,水作氧化剂;
⑤2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑中,氢元素化合价由+1价变为0价,氧元素化合价由-2价变为0价,所以水既是氧化剂又是还原剂;
⑥2F2+2H2O=4HF+O2中氟元素化合价由0价变为-1价,氧元素化合价由-2价变为0价,所以氟气是氧化剂,水是还原剂,
故答案为:①④;⑤;
(3)在上述氧化还原反应中,既有电子的得失又有电子对的偏移,所以氧化还原反应的实质是电子的得失及电子对的偏移,
故答案为:C.
点评 本题考查了氧化还原反应,明确元素化合价是解本题关键,根据元素化合价变化来分析解答即可,知道氧化还原反应本质和特征的区别,难度不大.

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案| A. | 过氧化钠 | B. | 氯化钠 | C. | 漂白粉 | D. | 新制氯水 |
①原子及其离子的核外电子层数等于该元素所在的周期数
②元素周期表中从IIIB族到IIB族10个纵行的元素都是金属元素
③除氦外的稀有气体原子的最外层电子数都是8
④第一周期元素、第VIIA族的元素和稀有气体元素都是非金属元素
⑤同主族元素的单质从上到下,非金属性减弱,熔点增高
⑥主族元素正化合价数,等于它的族序数
⑦元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑧酸性HClO4>H2SO4>H2CO3>H2SiO3.
| A. | ①⑤⑥⑦ | B. | ①③⑥⑦ | C. | ②③⑤⑥⑦ | D. | ②③④⑥⑧ |
| A. | 16.5g | B. | 85g•mol-1 | C. | 65 g | D. | 55g•mol-1 |
| A. | 第16、17列都是非金属元素 | |
| B. | 第1列金属元素和第17列元素的单质熔、沸点变化趋势相反 | |
| C. | 只有第2列元素原子最外层有2个电子 | |
| D. | 在18列元素中,第3列元素种类最多 |
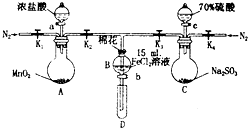 为验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).
为验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,关闭K2.
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子.
V.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程I的目的是排出装置中的空气,防止干扰.
(2)检验B中溶液是否还有Fe2+的方法之一是:取少量B中溶液于试管中,滴加几滴含有+3价铁元素的配合物溶液,会产生蓝色沉淀.写出该反应的离子方程式3Fe2++2(Fe(CN)6)3-=Fe3(Fe(CN)6)2↓.
(3)若向第III步B中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的离子方程式2Fe3++H2S═2Fe2++2H++S↓.
(4)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的化学方程式为2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4.
(5)甲、乙、丙三位同学分别完成了上述实验,结论如表所示.他们的检测结果一定不能够证明氧化性Cl2>Fe3+>SO2的是甲(填“甲”、“乙”或“丙”).
| 过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |

 ;
; ;
; ;
;
 )
) (其中两种)(任写两种)
(其中两种)(任写两种)