题目内容
15.标准状况下,0.1mol某烃与1molO2(过量)混和,完全燃烧后通过足量的过氧化钠固体,固体增重15克,从过氧化钠中逸出的全部气体为16.8L(标准状况),则该烃的分子式为( )| A. | C2H4 | B. | C3H8 | C. | C4H8 | D. | C5H10 |
分析 120℃,0.1mol烃与1molO2(过量)混合,完全燃烧后为CO2、H2O、O2(剩余)混合气体,混合气体通过足量的Na2O2固体,发生反应2CO2+2Na2O2=2Na2CO3+O2,Na2O2增重相当于与CO2等物质的量的CO的质量,发生反应2H2O+2Na2O2=4NaOH+O2,Na2O2增重相当于烃中H元素质量,从Na2O2中溢出的全部气体为16.8L(标况)为氧气,水中的氧元素完全转移到氧气中,反应2CO2+2Na2O2=2Na2CO3+O2导致整个过程中氧气的物质的量减小,根据氧气物质的量减少可以计算CO2的物质的量,再结合过氧化钠质量增重计算H元素的质量,根据原子守恒进而确定化学式,以此解答该题.
解答 解:120℃,0.1mol烃与1molO2(过量)混合,完全燃烧后为CO2、H2O、O2(剩余)混合气体,混合气体通过足量的Na2O2固体,发生反应2CO2+2Na2O2=2Na2CO3+O2,Na2O2增重相当于与CO2等物质的量的CO的质量,发生反应2H2O+2Na2O2=4NaOH+O2,Na2O2增重相当于烃中H元素质量,从Na2O2中溢出的全部气体为16.8L(标况)为氧气,水中的氧元素完全转移到氧气中,反应2CO2+2Na2O2=2Na2CO3+O2导致整个过程中氧气的物质的量减小,
从Na2O2中溢出的全部气体为16.8L(标况)为氧气,其物质的量=$\frac{16.8L}{22.4L/mol}$=0.75mol,故整个过程中氧气物质的量减少1mol-0.75mol=0.25mol,则:
2CO2+2Na2O2=2Na2CO3+O2 氧气物质的量减少
2 1
0.5mol 0.25mol
故烃中氢元素的质量=15g-0.5mol×28g/mol=1g,则氢原子物质的量=$\frac{1g}{1g/mol}$=1mol,
则该烃中C原子数目=$\frac{0.5mol}{0.1mol}$=5、H原子数目=$\frac{1mol}{0.1mol}$=10,
故该烃的分子式为:C5H10,
故选D.
点评 本题考查有机物分子式的确定,为高频考点,侧重于学生的分析、计算能力的考查,关键是根据整个过程中氧气的物质的量变化计算二氧化碳,注意理解差量法的应用,难度较大.

| A. | 漂粉精 | B. | 氨气 | C. | 烧碱 | D. | 纯碱 |
①原子及其离子的核外电子层数等于该元素所在的周期数
②元素周期表中从IIIB族到IIB族10个纵行的元素都是金属元素
③除氦外的稀有气体原子的最外层电子数都是8
④第一周期元素、第VIIA族的元素和稀有气体元素都是非金属元素
⑤同主族元素的单质从上到下,非金属性减弱,熔点增高
⑥主族元素正化合价数,等于它的族序数
⑦元素的非金属性越强,它的气态氢化物水溶液的酸性越强
⑧酸性HClO4>H2SO4>H2CO3>H2SiO3.
| A. | ①⑤⑥⑦ | B. | ①③⑥⑦ | C. | ②③⑤⑥⑦ | D. | ②③④⑥⑧ |
| A. | 16.5g | B. | 85g•mol-1 | C. | 65 g | D. | 55g•mol-1 |
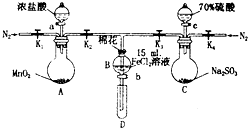 为验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).
为验证氧化性Cl2>Fe3+>SO2,某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略,气密性已检验).实验过程:
I.打开弹簧夹K1~K4,通入一段时间N2,再将T型导管插入B中,继续通入N2,然后关闭K1、K3、K4.
Ⅱ.打开活塞a,滴加一定量的浓盐酸,给A加热.
Ⅲ.当B中溶液变黄时,停止加热,关闭K2.
Ⅳ.打开活塞b,使约2mL的溶液流入D试管中,检验其中的离子.
V.打开K3和活塞c,加入70%的硫酸,一段时间后关闭K3.
Ⅵ.更新试管D,重复过程Ⅳ,检验B溶液中的离子.
(1)过程I的目的是排出装置中的空气,防止干扰.
(2)检验B中溶液是否还有Fe2+的方法之一是:取少量B中溶液于试管中,滴加几滴含有+3价铁元素的配合物溶液,会产生蓝色沉淀.写出该反应的离子方程式3Fe2++2(Fe(CN)6)3-=Fe3(Fe(CN)6)2↓.
(3)若向第III步B中的黄色溶液中通入H2S气体,会观察到有淡黄色沉淀生成,写出该反应的离子方程式2Fe3++H2S═2Fe2++2H++S↓.
(4)若将制取的SO2通入硫酸酸化的高锰酸钾溶液可使溶液褪色,其反应的化学方程式为2KMnO4+5SO2+2H2O=2MnSO4+K2SO4+2H2SO4.
(5)甲、乙、丙三位同学分别完成了上述实验,结论如表所示.他们的检测结果一定不能够证明氧化性Cl2>Fe3+>SO2的是甲(填“甲”、“乙”或“丙”).
| 过程Ⅳ,B溶液中含有的离子 | 过程Ⅵ,B溶液中含有的离子 | |
| 甲 | 有Fe3+无Fe2+ | 有SO42- |
| 乙 | 既有Fe3+又有Fe2+ | 有SO42- |
| 丙 | 有Fe3+无Fe2+ | 有Fe2+ |
| A. | 水 | B. | 氨水 | C. | 醋酸 | D. | 氯化钠 |
 图中硬质试管A中放入干燥洁净的细铜丝,烧杯中放入温水,试管B中放入甲醇,右方试管C中放入冷水.向B中不断鼓入空气,使甲醇蒸气和空气通过加热到红热程度的铜丝.
图中硬质试管A中放入干燥洁净的细铜丝,烧杯中放入温水,试管B中放入甲醇,右方试管C中放入冷水.向B中不断鼓入空气,使甲醇蒸气和空气通过加热到红热程度的铜丝.