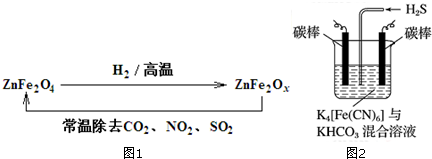
题目内容
12.配平下列化学反应方程式,把化学计量数以及相关物质(写化学式)填写在空格上,并用双线桥标出电子转移的方向和数目.5PbO2+2MnSO4+6HNO3═2HMnO4+3Pb(NO3)2+2PbSO4↓+2H2O.
分析 反应中二氧化铅中+4价铅,化合价降为硝酸铅、硫酸铅中+2价,硫酸锰中+2价锰化合价升高为高锰酸中+7价,依据氧化还原反应中得失电子守恒、原子个数守恒配平方程式;
依据元素化合价变化判断电子转移方向及数目,用双线桥表示.
解答 解:应中二氧化铅中+4价铅,化合价降为硝酸铅、硫酸铅中+2价,硫酸锰中+2价锰化合价升高为高锰酸中+7价,依据得失电子守恒,二者得失电子最小公倍数为10,则二氧化铅系数为5,硫酸锰系数为5,依据原子个数守恒,方程式:5PbO2+2MnSO4+6HNO3═2HMnO4+3Pb(NO3)2+2PbSO4↓+2H2O;
反应中二氧化铅中+4价铅得到电子,硫酸锰中+2价锰失去电子,消耗5mol二氧化铅转移10mol电子,用双线桥表示为: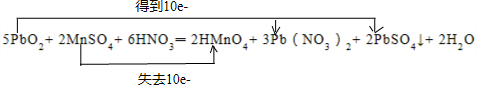 ;
;
故答案为: .
.
点评 本题考查了氧化还原反应方程式书写及表示方法,准确分析反应中元素化合价变化,依据氧化还原反应得失电子数守恒、原子个数守恒规律即可解答,题目难度中等.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
4.下列实验操作合理的是( )
| A. |  用标准液滴定待测液 | B. |  检查装置气密性 | ||
| C. |  蒸发 | D. |  读取气体体积 |
7.下列物质不属于空气污染物的是( )
| A. | SO2 | B. | N2 | C. | NO2 | D. | NO |
4.对下列说法,正确的说法是( )
| A. | 放热的反应发生时不必加热,吸热反应都需要加热后才能发生 | |
| B. | 化学反应的反应热只与反应体系的始态和终点状态有关,而与反应的途径无关 | |
| C. | 化学反应一定有能量变化,当△H为“-”时,表示该反应为吸热反应 | |
| D. | 已知C(s)+$\frac{1}{2}$O2(g)=CO(g)的反应热为-110.5kJ/mol,说明碳的燃烧热为110.5kJ/mol |
1.往三氯化铁溶液中加入下列溶液后,会出现红褐色沉淀的是( )
| A. | NaOH | B. | BaCl2 | C. | H2SO4 | D. | HNO3 |